
| A. | v(H2)=0.8mol/(L•s) | B. | v(N2)=0.4mol/(L•s) | ||
| C. | v(NH3)=0.6mol/(L•s) | D. | v(H2)=4.2mol/(L•min) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位保持一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快.
A.$\frac{v({H}_{2})}{3}$=0.267mol/(L•s);
B.$\frac{v({N}_{2})}{1}$=0.4mol/(L•s);
C.$\frac{v(N{H}_{3})}{2}$=0.3mol/(L•s)
D.$\frac{v({H}_{2})}{3}$=1.2mol/(L•min)=0.02mol/(L•s),
故反应速率B>C>A>D,
故选:B.
点评 比较反应速率常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.


科目:高中化学 来源: 题型:填空题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合的离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64gCu被氧化,失去的电子数一定为2NA | |
| B. | 室温下,pH=13的氨水中,由水电离的OH-数为0.1NA | |
| C. | 在标准状况下,22.4LC4H10中共价键数目为13NA | |
| D. | 200mL1mol/LFe2 ( SO4)3 溶液中,SO42-离子数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的结构示意图: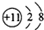 | |
| B. | 氢氧根离子的电子式: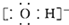 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| D. | Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应达到平衡状态 | |
| B. | 该反应正在向左方向进行 | |
| C. | 达平衡状态时,H2的转化率应为96.3% | |
| D. | 增大H2的量,该反应平衡常数将减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com