
| A. | H2O | B. | H3O+ | C. | NH3 | D. | NH${\;}_{4}^{+}$ |
分析 分子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数-配原子个数×配原子形成稳定结构需要的电子数),阳离子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数-电荷数-配原子个数×配原子形成稳定结构需要的电子数),阴离子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数+电荷数-配原子个数×配原子形成稳定结构需要的电子数),据此分析解答.
解答 解:A.H2O分子中孤电子对个数=$\frac{1}{2}$(6-2×1)=2;
B.H3O+中孤电子对个数=$\frac{1}{2}$(6-1-3×1)=1;
C.NH3分子中孤电子对个数=$\frac{1}{2}$(5-3×1)=1;
D.NH4+中孤电子对个数=$\frac{1}{2}$(5-1-4×1)=0.
故选D.
点评 本题考查了化合物中孤电子对个数的计算方法,根据价层电子对互斥理论计算即可,注意其阴阳离子孤电子对个数的计算方法,为易错点,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 乙烯可以用向下排空气法收集 | |
| C. | 乙烷、乙醇和乙酸都可以和钠反应生成氢气 | |
| D. | 苯是比水轻,有特殊气味的无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
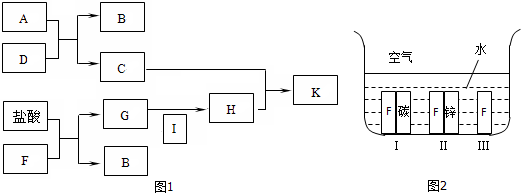
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| B. | 此时水的电离程度最大 | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为 $\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com