
分析 X、Y是相邻周期、相邻主族的短周期元素,且原子序数X>Y,X处于第三周期、Y处于第二周期,
Ⅰ.若X为金属元素,Y为非金属元素,则X为Al、Y为C元素,Y2H4为乙烯;
(1)乙烯是重要有机化工原料,可以生成塑料等;
(2)发生反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,计算2molAl反应放出的热量,注明聚集状态、反应热,进而书写热化学方程式;
(3)实验室利用乙醇在浓硫酸、170℃条件下发生消去反应制备乙烯;
Ⅱ.若X、Y元素的最高价氧化物的水化物都是强酸,第二周期中只有N元素最高价含氧酸为强酸,故Y为N元素,则X为S元素;
(4)①反应中N元素化合价降低,发生还原反应,故G具有还原性,再结合元素守恒可知,G应含有H元素,据此判断;
②根据得失电子守恒和原子守恒配平方程式;
(5)NH3•H2O为弱电解质,与硫酸反应生成硫酸铵为强电解质,溶液导电性增强;
根据电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+c(H+),溶液显中性时c(H+)=c(OH-),据此计算溶液中c(NH4+)、c(OH-),根据物料守恒计算溶液中c(NH3.H2O),代入电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:X、Y是相邻周期、相邻主族的短周期元素,且原子序数X>Y,X处于第三周期、Y处于第二周期.
Ⅰ.若X为金属元素,Y为非金属元素,则X为Al、Y为C元素,Y2H4为乙烯;
(1)乙烯是重要有机化工原料,可以生成塑料等,故答案为:生成塑料;
(2)发生反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,每消耗13.5g Al放热213kJ,则2molAl参加反应放出热量为213kJ×$\frac{2mol×27g/mol}{13.5g}$=852kJ热量,所以其热化学反应方程式为:2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-852kJ•mol-1,
故答案为:2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-852kJ•mol-1;
(3)实验室利用乙醇在浓硫酸、170℃条件下发生消去反应制备乙烯,反应方程式为:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O;
Ⅱ.若X、Y元素的最高价氧化物的水化物都是强酸,第二周期中只有N元素最高价含氧酸为强酸,故Y为N元素,则X为S元素;
(4)①反应中N元素化合价降低,发生还原反应,故G具有还原性,再结合元素守恒可知,G应含有H元素,所以G不可能是CO,故选:B;
②Ge(OH)CO3→GeO2,失去一个电子,O2中氧元素降低为-2,得到4个电子,所以得失电子最小公倍数是4,则Ge(OH)CO3的计量数是4,O2的计量数是1,然后根据原子守恒平衡,所以该反应方程式为:4Ge(OH)CO3+1O2═4GeO2+4CO2+2H2O,
故答案为:4;1;4;4;2;
(5)25℃时,往a mol•L-1的NH3的水溶液(甲)中滴加0.01mol•L-1H2SO4溶液(乙),NH3•H2O为弱电解质,溶液的导电性较弱,滴加过程中生成强电解质,溶液的导电能力增强;
根据电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+c(H+),溶液显中性时c(H+)=c(OH-),则c(NH4+)=2c(SO42-),c(OH-)=10-7mol/L,等体积混合硫酸根离子的浓度变为原来的一半,则c(NH4+)=2c(SO42-)=2×0.005mol•L-1=0.01mol•L-1,故混合后溶液中c(NH3.H2O)=$\frac{a}{2}$mol•L-1-0.01mol•L-1=($\frac{a}{2}$-0.01)mol/L,又电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.01×1{0}^{-7}}{(0.5a-0.01)}$=$\frac{2×1{0}^{9}}{a-0.02}$,
故答案为:增强;$\frac{2×1{0}^{9}}{a-0.02}$.
点评 本题综合性较强,涉及位置结构性质关系应用、热化学方程式书写、乙烯的实验室制备原理、氧化还原反应配平、电离平衡常数的计算等,(5)中注意利用电荷守恒、物料守恒计算离子浓度,是对学生综合能力的考查,难度中等.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
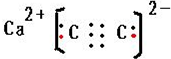 ;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).
;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
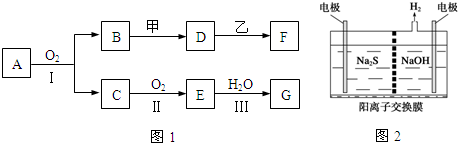
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C可形成一种含不同类型的化学键的碱性氧化物 | |
| B. | D2-离子在水溶液中与Al3+、H+均不能大量共存 | |
| C. | A2B的稳定性强于A2D的稳定性 | |
| D. | A2D和DB2可发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1 mol/L-1SO2的溶液中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO3-、SO42- | |
| C. | 碱性溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、MnO4-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X=0.6mol | |
| B. | 离子的物质的量关系满足n(Cl-)=5n(ClO-)+n(ClO3-) | |
| C. | 若反应中转移的电子为n mol,则有0.3<n<0.5 | |
| D. | ClO3-的物质的量范围是:0.1mol<n(ClO3-)<0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
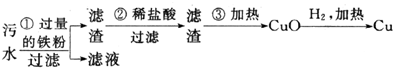
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com