
| A. | 石油的裂化 | B. | 氯水使有色布条褪色 | ||
| C. | 活性炭使红墨水褪色 | D. | 石油的分馏 |
分析 化学变化有新物质的生成,物理变化没有新物质的生成,化学变化和物理变化的根本区别为是否有新物质的生成,据此分析.
解答 解:A.石油裂化是一种使烃类分子分裂为几个较小分子的反应过程,有新物质生成,属于化学变化,故A正确;
B.氯水中含有的次氯酸具有强氧化性,能使有色布条褪色,属于化学变化,故B正确;
C.活性炭具有很强的吸附性,能使红墨水褪色,属于物理变化,故C错误;
D.石油的分馏是根据沸点不同,将各组分加以区分,属于物理变化,故D错误;
故选AB.
点评 本题考查物理变化与化学变化的区别与联系,涉及化学反应与生活、生产的考查,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题
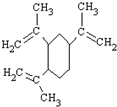
| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 1 mol 榄香烯最多能和3 mol H2反应 | |
| D. | 榄香烯不能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
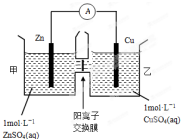
| A. | 都具有强氧化性 | |
| B. | 在常温下都能与铜反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
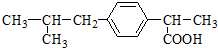
| A. | 该物质属于不饱和烃 | B. | 该物质的分子式为C13H20O2 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子是碳碳单双键交替相连的结构,因此苯环上碳碳键的键长都不相等 | |
| B. | 苯主要是从石油分馏而获得的一种重要化工原料 | |
| C. | 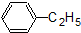 属于脂环化合物 属于脂环化合物 | |
| D. | 苯是一种无色液体,难溶于水,密度比水小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
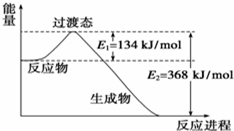 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.
20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
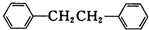 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: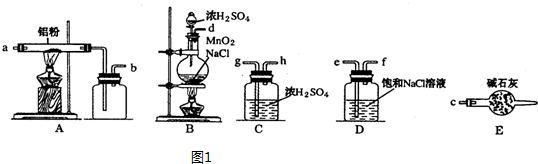
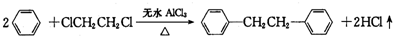
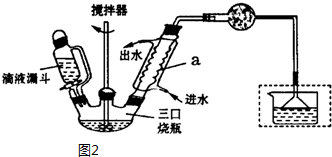
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2一二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com