
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |
| △c |
| △t |
| 0.3mol/L |
| 15s |
| 2 |
| 3 |
| 0.63×0.5 |
| 0.82 |
| 1.4 |
| 2 |
| 0.8 |
| 2 |
| 13×0.5 |
| 1.52 |
| 1 |
| 2 |
| 1 |
| 2 |
| 10-7×0.05 |
| 0.5a-0.05 |
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |


科目:高中化学 来源:2011-2012学年山东省潍坊市高三上学期期末考试化学试卷 题型:填空题
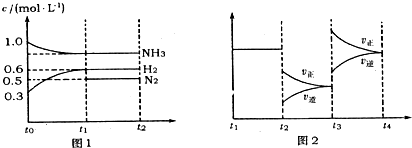
(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3 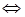 N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
(1)能证明反应达到平衡状态的是 (填标号,下同)。
A.容器内压强不再发生变化 B. N2的体积分数不再发生变化
C. 容器内气体质量不再发生变化 D. 容器内气体密度不再发生变化
(2)若tl=15 s,则t0-t1阶段以H2浓度变化表示的反应速率为 。
(3)t3-t4阶段改变的条件为 。
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b. 氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省潍坊东营市高三(上)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3 ![]() N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
(1)能证明反应达到平衡状态的是 (填标号,下同)。
A.容器内压强不再发生变化 B. N2的体积分数不再发生变化
C. 容器内气体质量不再发生变化 D. 容器内气体密度不再发生变化
(2)若tl=15s,则t0-t1阶段以H2浓度变化表示的反应速率为 。
(3)t3-t4阶段改变的条件为 。
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b. 氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省潍坊市高三上学期期末考试化学试卷 题型:填空题
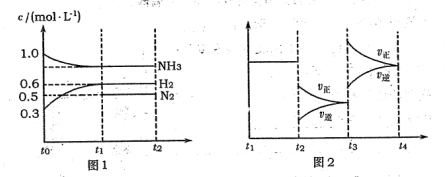
(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3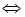 N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
(1)能证明反应达到平衡状态的是 (填标号,下同)。
| A.容器内压强不再发生变化 | B.N2的体积分数不再发生变化 |
| C.容器内气体质量不再发生变化 | D.容器内气 体密度不再发生变化 体密度不再发生变化 |
 。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com