
 用下面两种方祛可以制得白色的Fe(OH)2沉淀.
用下面两种方祛可以制得白色的Fe(OH)2沉淀.分析 (1)用铁与稀硫酸反应可制得FeSO4溶液;
(2)根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁分析;
(3)同(1);
(4)生成的氢气使装置Ι中压强变大,使Ι中的药品硫酸亚铁进入Ⅱ中,与Ⅱ中的药品氢氧化钠反应得到氢氧化亚铁;
(5)氢气充满试管I和试管II,且空气不易进入装置.
解答 解:(1)铁与稀硫酸反应生成硫酸亚铁和氢气,可制得FeSO4溶液;
故答案为:稀H2SO4、铁屑;
(2)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的;
故答案为:避免生成的Fe(OH)2沉淀接触O2;
(3)在试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液;
故答案为:稀H2SO4、铁屑;
(4)试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,并能产生氢气,当氢气使装置Ι中压强变大,使Ι中的药品硫酸亚铁进入Ⅱ中,与Ⅱ中的药品氢氧化钠反应得到氢氧化亚铁,发生的离子方程式为:Fe2++2OH-=Fe(OH)2↓;
故答案为:NaOH溶液;Fe2++2OH-=Fe(OH)2↓;
(5)试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入,这样获得的氢氧化亚铁可以不被氧气氧化而变质;
故答案为:试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入.
点评 获得氢氧化亚铁隔绝空气是关键,要求学生学会看图,能看懂题目中所给的装置图,每一部分的作用,只有这样才能明确反应是怎么进行的.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:实验题
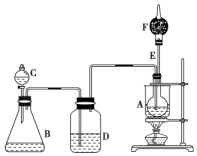 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )| A. | 只有①②③ | B. | 只有④⑤⑥ | C. | 只有①②④⑤⑥ | D. | 以上都可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再通入1molO2,平衡正向移动,平衡常数不变 | |
| B. | 降低温度,正反应速率先减小后增大 | |
| C. | 平衡时SO2气体的转化率为50% | |
| D. | 该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.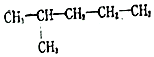 2-甲基戊烷
2-甲基戊烷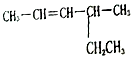 4-甲基-2-己烯.
4-甲基-2-己烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制100g20%的氢氧化钠溶液(烧杯、100mL容量瓶、胶头滴管) | |
| B. | 钠的焰色反应(铂丝、硫酸钠溶液、稀盐酸) | |
| C. | 从碘水中提取碘(蒸发皿、酒精灯、玻璃棒) | |
| D. | 除去自来水中的Cl-(铁架台、玻璃棒、漏斗) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水解达到平衡时(不饱和),加氯化铁溶液达饱和,溶液的酸性会增强 | |
| B. | 浓度为5 mol•L-1和0.5 mol•L-1的两种 FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 | |
| C. | 有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3+的水解程度前者比后者小 | |
| D. | 为抑制 Fe3+的水解,较好地保存 FeCl3溶液,应加少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 使用正催化剂、升高温度、增大反应物浓度,都可以增大正反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com