
| A. | 元素非金属性:Z<X<Y | |
| B. | 原子半径:W>Z>Y | |
| C. | 0.1mol/L溶液pH:X2Z<XW | |
| D. | Z2W2中各原子都达到稳定结构,其电子式是  |
分析 X、Y、Z、W是4种原子序数依次增大的短周期元素,其中X原子在元素周期表中原子半径最小,X为H,Y、Z位于同一主族,Y应为第二周期元素,Y原子的最外层电子数是其电子层数的3倍,可知Y的最外层电子数为6,Y为O,Z为S,结合W的原子序数最大,W为Cl,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为S,W为Cl,
A.同主族从上到下非金属性减弱,硫化氢中H为+价,则元素非金属性:X<Z<Y,故A错误;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Z>W>Y,故B错误;
C.X2Z为弱酸,XW为强酸,HCl完全电离,氢离子浓度越大pH越小,0.1mol/L溶液pH:X2Z>XW,故C错误;
D.Z2W2为S2Cl2,S与Cl形成共价键,各原子都达到稳定结构,其电子式是  ,故D正确;
,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素的性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 在电解精炼铜时,当电路中通过的电子数为2NA时,阳极质量减少64g | |
| B. | 标准状况下,22.4 LCO和C2H4混合气体的总分子数为NA,质量为28g | |
| C. | 常温常压下,1mol甲基(-CH3)所含电子数为10NA | |
| D. | 标准状况下,11.2L苯中含有C-H键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “甘之如饴”说明糖类均有甜味 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶具有丁达尔效应 | |
| D. | 古剑“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
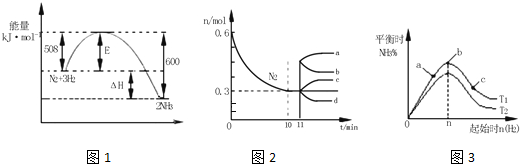
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水:NH4+、Cl-、[Cu(NH3)4]2+ | |
| B. | 通入过量Cl2:Fe2+、Cu2+、C-、H+ | |
| C. | 加入过量铁粉:Cu2+、Fe2+、Cl-、H+ | |
| D. | 加入过量KSCN溶液:Na+、K+、Fe3+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
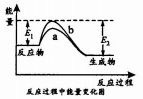
| A. | △H=+|E1-E2| | |
| B. | 曲线a为催化剂时的反应 | |
| C. | X(g)的能量高于Z(g)的能量 | |
| D. | 反应物吸收的总能量大于生成物释放的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA | |
| C. | 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com