
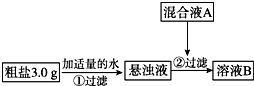
 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
分析 无机融雪剂氯化钠、氯化钙、氯化镁中的镁离子可以用氢氧化钠进行检验,氯化钙可以用碳酸钠来检验,加入相应的试剂后,可以得到氯化钠的溶液;
(1)根据镁离子和钙离子的沉淀条件来选择合适试剂;
(2)检验溶液B中的Mg2+、Ca2+,根据沉淀看是否有沉淀来检验;
(3)根据氢氧化镁的Ksp=c(Mg2+)•c2(OH-)来计算即可;
(4)根据除杂的原则:能和杂反应同时不引进杂质离子,氢氧化钠和碳酸钠中的阴离子可以用氢离子来除去;
(6)CaCO3在水中存在溶解平衡,根据选项中的物质中的离子对碳酸钙的溶解是促进还是抑制来分析Ca2+的浓度.
解答 解:无机融雪剂氯化钠、氯化钙、氯化镁中的镁离子可以用氢氧化钠进行检验,氯化钙可以用碳酸钠来检验,加入相应的试剂后,可以得到氯化钠的溶液;
(1)氯化镁中的镁离子可以用氢氧化钠进行检验,氯化钙可以用碳酸钠来检验,所以加入混合液A的主要成分是NaOH、Na2CO3,
故答案为:NaOH、Na2CO3;
(2)镁离子与强碱反应生成沉淀,可以用氢氧化钠检验镁离子,根据沉淀的溶度积数值的大小,数值越小,说明将钙离子沉淀需要的溶液的浓度越小,故效果最好的是碳酸钠溶液,
故答案为:NaOH;A;
(3)加热能加快沉淀生成,根据氢氧化镁的Ksp=[Mg2+][OH-]2,所以[Mg2+]=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.8×1{0}^{-11}}{1{0}^{-4}}$=1.8×10-7( mol•L-1),
故答案为:1.8×10-7mol•L-1;
(4)加热并不断滴加6mol•L-1的盐酸溶液,可以将溶液中多余的氢氧化钠和碳酸钠除去,
故答案为:除去NaOH和Na2CO3;
(6)①CaCO3加入30mL水中,充分溶解至溶液饱和存在:CaCO3(s)?Ca2+(aq )+CO32-(aq),则溶液中存在一定浓度的Ca2+,但浓度较小;
②将足量CaCO3加入10mL 0.2mol/L Na2CO3溶液中,由于碳酸根离子的浓度较大,抑制碳酸钙的溶解,则Ba2+的浓度很小;
③将足量CaCO3加入50mL 0.01mol/L氯化钙溶液中,氯化钙电离产生0.01mol/LCa2+,则Ca2+的浓度较大;
④将足量CaCO3加入100mL0.01mol/L盐酸中,碳酸钙与盐酸反应生成0.005mol/LCa2+,则Ca2+的浓度较大;
所以Ca2+的浓度由大到小的顺序为:③>④>①>②;
故选③④①②,
故答案为:③④①②.
点评 本题是一道关于粗盐的提纯知识的综合实验题,题目难度中等,考查学生分析和解决问题的能力,掌握基础是解题关键.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯(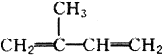 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(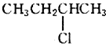 )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 新戊烷和氯气发生取代反应生成一氯取代物的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com