
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
分析 亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:A.氯水能将亚铁离子氧化为铁离子,铁离子和KSCN溶液反应导致溶液呈血红色,但不能确定原来溶液中一定含有亚铁离子,故A错误;
B.铁粉和酸反应生成亚铁离子,不能确定原来溶液中是否含有亚铁离子,故B错误;
C.浓氨水和亚铁离子反应生成氢氧化亚铁沉淀,氢氧化亚铁能被氧化生成氢氧化铁红褐色沉淀,不能确定溶液中一定含有亚铁离子,故C错误;
D.亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液检验亚铁离子,故D正确;
故选D.
点评 本题考查离子的检验,为高频考点,把握亚铁离子的还原性为解答的关键,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
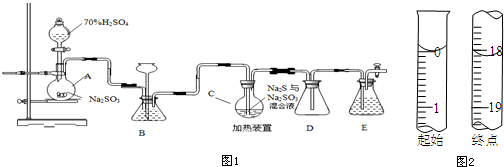
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粉身碎骨浑不怕,要留清白在人间 | B. | 曾青得铁则化为铜 | ||
| C. | 春蚕到死丝方尽,蜡炬成灰泪始干 | D. | 水滴石穿 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com