
 |  |  |  |
| A.从NaCl溶液提取NaCl固体 | B.实验室中制取少量蒸馏水 | C.闻氯气的气味 | D.分离油和水混合物 |
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 除杂质所用试剂和方法 |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | CaCO3 | CaO | 盐酸,过滤 |
| D | Mg粉 | Al粉 | NaOH溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
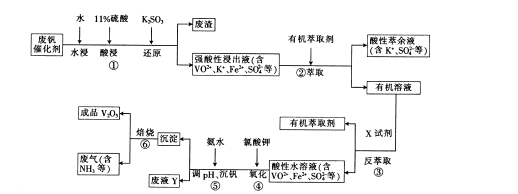
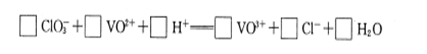
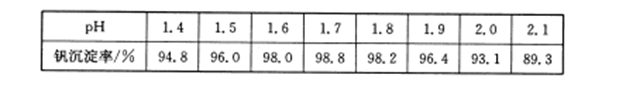
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
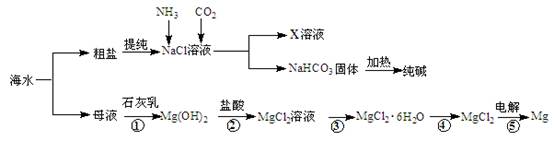
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加入Na2CO3溶液,若有白色沉淀生成,证明一定含有Ca2+ |
| B.向某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有CO32— |
| C.向某溶液中滴加KSCN溶液,若溶液出现红色则说明原溶液中含Fe3+ |
| D.向某溶液中先加稀硝酸,再加BaC12溶液,生成白色沉淀,证明一定含有SO42— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cr2O3)冶炼铬,简要流程如下:
Cr2O3)冶炼铬,简要流程如下:
 4Na2CrO4+Fe2O3+4CO2+______________。
4Na2CrO4+Fe2O3+4CO2+______________。
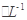 的硫酸亚铁铵[ (NH4)2Fe(SO4)
的硫酸亚铁铵[ (NH4)2Fe(SO4) ]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
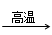 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.①②④ | C.①②③ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作及现象 | 结论 |
| A | 溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
| B | 某溶液中加入硝酸银,产生白色沉淀 | 溶液中一定含有Cl- |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
| D | 向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com