
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
分析 从两个角度考虑,一是可逆反应,二是物质的性质与浓度有关,例如某些酸在浓度较大时具有较强的氧化性或还原性,当浓溶液时可以发生反应,但随着反应的消耗,变成稀溶液往往就不具备继续反应的性质.
解答 解:①稀硫酸与块状石灰石反应生成微溶物硫酸钙,附着在碳酸钙表面阻止反应的进一步发生,故①正确;
②合成氨是一个可逆反应,无论如何充分反应,都不能完全反应而达到百分之百,故②正确;
③过量稀硝酸与银反应,银完全反应,故③错误;
④铜无法与稀硫酸反应,无论铜怎么过量,都不能完全消耗完硫酸,故④正确;
⑤浓盐酸反应到最后变成稀盐酸了,无法完全反应,浓盐酸中H+和Cl-的浓度大,还原性强,在加热条件下能被MnO2氧化,生成Cl2;随反应进行,H+和Cl-的浓度逐渐减小,还原性逐渐减弱,当达到一定程度时,MnO2就不可以氧化Cl-了.因此二氧化锰和稀盐酸不会反应,故⑤正确;
⑥锌不论与浓硫酸还是稀硫酸都能反应,一种物质过量时,另一种能完全反应,故⑥错误
故选C.
点评 本题考查物质的性质,难度不大,注意化学反应中的一些特殊情况,本题的可逆性和浓度问题.


科目:高中化学 来源: 题型:解答题
 双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.
双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
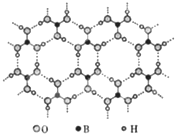 正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )| A. | 正硼酸晶体属于分子晶体 | B. | H3BO3分子的稳定性与氢键有关 | ||
| C. | 分子中硼原子最外层不是8e-结构 | D. | 含1mol H3BO3的晶体中有3mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,具有较强的去油污能力 | |
| B. | Al2(SO4)3与NaHCO3溶液可用作消防器材中的灭火剂 | |
| C. | NaCl可用作防腐剂和调味剂 | |
| D. | 焊接时用NH4Cl溶液除锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液振荡 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中振荡,静置,分液 | |
| D. | 乙烯中混有SO2和CO2,将其通入酸性KMnO4溶液中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
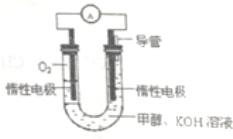 科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com