
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+
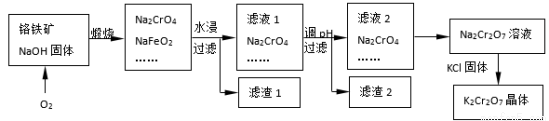
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2
(1)+6(2分)
(2)NaOH、NaAlO2;(2分,只写一项得1分,多写或错写得0分)
NaFeO2+2H2O=Fe(OH)3↓+NaOH;(3分)
(3)加硫酸酸化(2分)
(4)4[FeO·Cr2O3] + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O(3分)
8Na2CrO4 + 4NaFeO2+ 10H2O(3分)
(5)①滴入最后一滴标准溶液,生成砖红色沉淀,且30s内沉淀不消失(2分)②B (2分)
【解析】
试题分析:(1)根据化合物中各元素的化合价代数和为0的原则判断K2Cr2O7中Cr元素的化合价是+6价;
(2)由流程图判断,滤液1的成分除Na2CrO4、Na2SiO3外,氧化铝与氢氧化钠反应生成的NaAlO2,还含有过量的NaOH;
滤渣1是红褐色的氢氧化铁,是NaFeO2水解生成的,化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(3)滤液2中存在Cr2O72-+ H2O 2CrO42-+ 2H+,由滤液2转化为Na2Cr2O7溶液应使平衡逆向移动,所以应加酸酸化;
2CrO42-+ 2H+,由滤液2转化为Na2Cr2O7溶液应使平衡逆向移动,所以应加酸酸化;
(4)流程图的第一步是铬铁矿在加热条件下与氢氧化钠、氧气反应生成Na2CrO4和NaFeO2,化学方程式为
4[FeO·Cr2O3] + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O
8Na2CrO4 + 4NaFeO2+ 10H2O
(5)①由沉淀的溶度积判断,滴入硝酸银溶液时先生成氯化银白色沉淀,氯离子沉淀完全后才生成Ag2CrO4的砖红色沉淀,所以滴定终点时有砖红色沉淀生成。②若用AgNO3溶液滴定NaSCN溶液,AgSCN与AgCl、AgBr相比,溶解度较大,所以若选用AC,则先生成AgCl、AgBr,而且颜色变化不明显,选用B,则先生成AgSCN,终点时有砖红色沉淀生成,所以选择K2CrO4可以指示滴定终点。
考点:考查对流程图的分析,物质的判断,平衡的移动,化学方程式的书写,沉淀的转化


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g) △H=+ 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
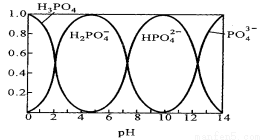
(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
A、C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh (写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
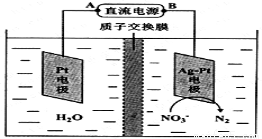
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为 (填A或B),阴极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
甲醇、氧气和强碱溶液做电解质的手机电池中的反应为:
2CH3OH+3O2+4OH-  2CO32-+6H2O,有关说法正确的是
2CO32-+6H2O,有关说法正确的是
A.放电时,CH3OH参与反应的电极为正极
B.放电时,负极电极反应:CH3OH+8OH--6e- =CO32-+6H2O
C.标况下,通入11.2LO2完全反应有1mol电子转移
D.充电时电解质溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:填空题
(1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。
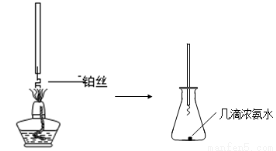
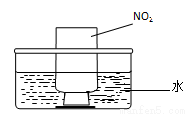
图a 图b
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式 。
②参照示例完成下表实验方案的设计。
限选材料:0.05mol?L-1Fe(NO3)3、0.5mol?L-1Fe(NO3)3、1.0mol?L-1HNO3、1.0mol?L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;pH计及其他常见仪器。
可能影响因素 | 实验操作 | 预期现象和结论 |
溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
盐的浓度 |
|
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.H+、NO3-、I-、Cl-
B.Cu2+、Br-、H+、SO42-
C.Al3+、Mg2+、CO32-、NO3-
D.NH4+、Cl-、OH-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:选择题
常温时,下列各溶液中,离子的物质的量浓度关系正确的是
A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
B.pH=2的醋酸中:c(H+)=0.02mol?L-1
C.0.1 mol?L-1氯化铵溶液中:c(H+)> c(OH-)> c(Cl-)> c(NH4+)
D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:实验题
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A. 连接全部仪器,使其成为如图装置,并检查装置的气密性。
B. 称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D. 以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
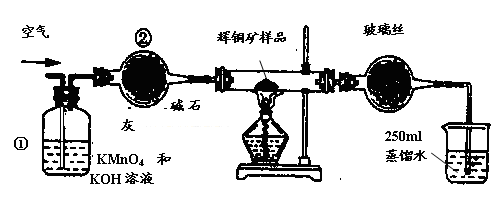
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生______________________________ _的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种既可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1 . 0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
下列有关实验的做法错误的是
A.用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出
B.检验NH4+时,向试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体
C.通过分液漏斗滴加溶液时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔
D.玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、除杂及收集装置如图所示。仅用此装置和表中提供的物质完成相关实验,最合理的是
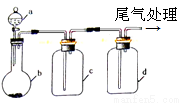
选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
A | 浓氨水 | CaO | 浓H2SO4 | NH3 |
B | 浓硫酸 | Na2SO3 | 浓H2SO4 | SO2 |
C | 饱和食盐水 | 电石 | CuSO4溶液 | CH≡CH |
D | 浓盐酸 | MnO2 | 饱和NaCl溶液 | Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com