
| 编号 | A | B | C |
发 生 装 置 | 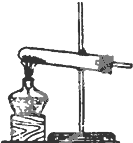 |  | 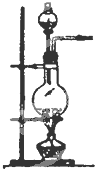 |
分析 (1)实验室用氯酸钾和二氧化锰制氧气时,选择固体加热装置;
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,选择固体与液体加热装置;
(3)(a)①反应电子转移的数目为10e-;
②反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,氯元素化合价由HCl中的-1升高为氯气中的0价;
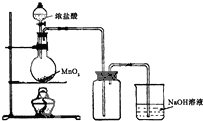
(b)①浓盐酸与二氧化锰反应生成氯化锰、氯气、水;
②生成氯气有毒,应选NaOH溶液吸收尾气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)实验室用氯酸钾和二氧化锰制氧气时,选择固体加热装置,只有A装置符合,
故答案为:A;
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,选择固体与液体加热装置,只有C装置符合,发生的反应为NaCl+H2SO4$\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑,
故答案为:C;NaCl+H2SO4$\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(3)(a)①失去的电子为5×2×(1-0)e-=10e-,单线桥标出反应中电子的转移方向和数目为: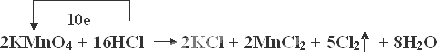 ,
,
故答案为: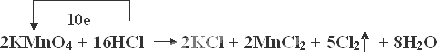 ;
;
②反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7降低为+2,KMnO4为氧化剂,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,HCl为还原剂,Cl元素被氧化,当有1mol电子转移时,可生成气体1mol×$\frac{5}{10}$×22.4L/mol=11.2L,
故答案为:Cl;KMnO4;11.2;
(b)①浓盐酸与二氧化锰反应生成氯化锰、氯气、水,反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②生成氯气有毒,应选NaOH溶液吸收尾气,则可以向烧瓶中加入的溶液是NaOH,发生的反应为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查常见气体的制备,为高频考点,把握制备原理及实验装置的作用为解答的关键,注意物质的性质及氧化还原反应原理的分析,题目题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 向NaBr溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 |
| 向KI溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 |
| 向KI溶液中滴入溴水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.75mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=1.0mol/(L•s) | D. | v(D)=0.8mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、Fe3+、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 氧化钠和过氧化钠的组成元素相同,都可以与CO2反应且产物相同 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
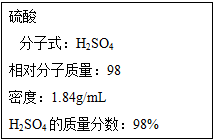 如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com