
| A. | 向煤中加入适量CaO,可大大减少燃烧产物中SO2的量 | |
| B. | 葡萄酒中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
分析 A.依据煤脱硫原理是钙基固硫,是利用氧化钙和二氧化硫反应生成亚硫酸钙,被氧化为硫酸钙除去分析;
B.碳酸钠溶液呈碱性,花青素在碱性环境下显蓝色;
C.纳米粒子是指粒度在1-100nm之间的粒子,与胶体相同,胶体的聚沉属于物理变化;
D.根据二氧化硫、二氧化氮是形成酸雨的主要物质;为减少酸雨的产生,只要减少二氧化硫、氮氧化物就可以防止酸雨的产生.
解答 解:A.煤脱硫原理是钙基固硫,是利用氧化钙和二氧化硫反应生成亚硫酸钙,被氧化为硫酸钙除去,向煤中加入适量CaO可大大减少燃烧产物中SO2的量,故A正确;
B.苏打为碳酸钠,碳酸钠溶液呈碱性,花青素在碱性环境下显蓝色,向葡萄酒中加入碳酸钠,如果溶液不变蓝,说明是假葡萄酒,故B正确;
C.石油裂解、煤的干馏、玉米制醇、均有新物质生成,属于化学变化,但是纳米银粒子的聚集属于小颗粒的胶体离子变成大颗粒聚成下来,没有新物质生成,蛋白质的变性也可能属于物理变化,故C错误;
D.采用燃料脱硫技术可以减少二氧化硫的产生,从而防止出现酸雨,NOx的催化转化生成无污染的氮气也是减少酸雨的有效措施,故D正确;
故选C.
点评 本题考查了环境污染及治理方法,题目难度不大,明确常见环境污染的类型及治理方法为解答关键,试题侧重基础知识的考查,有利于提高学生的环境保护意识.


科目:高中化学 来源: 题型:推断题
 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子.回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子.回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
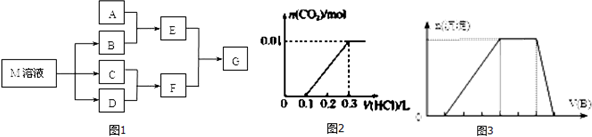
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、H+、Cl-、SCN-可以大量共存 | |
| B. | 通入H2S气体至过量会生成两种沉淀 | |
| C. | 加入NaOH溶液至Fe3+刚好沉淀完全的离子方程式:NH4++Fe3++4OH-═Fe(OH)3↓+NH3•H2O | |
| D. | 离子浓度关系:c(SO42-)>c(NH4+)>c(Fe3+ )>c(H+ )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中氧元素的化合价是-2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 16S的结构示意图: | D. | 甲烷的结构式为: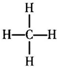 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子的两种原子 | |
| D. | 两原子的核外全部都是s电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
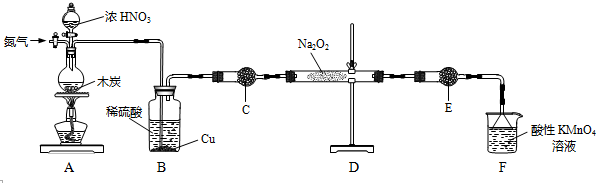
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.
X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com