
【题目】向绝热恒容密闭容器中通入N2和H2 , 在一定条件下使反应N2(g)+3H2(g)2NH3(g)△H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示.下列有关叙述正确的是( ) 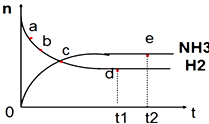
A.c点表示NH3生成速率与NH3分解速率相同
B.c点和e点时反应的平衡常数相同
C.N2的转化率:b>a
D.d点时,n(N2):n(H2):n(NH3)=1:3:2
【答案】C
【解析】解:A.随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则c点还未达到平衡状态,故NH3生成速率与NH3分解速率不相同,故A错误;
B.该反应为放热反应,在绝热恒容密闭容器中,温度不断升高,平衡常数会减小,故B错误;
C.随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,b点参加反应的氮气要比a点多,所以N2的转化率:b>a,故C正确;
D.d点时反应处于平衡状态,n(N2):n(H2):n(NH3)的值与起始量有关,不一定为1:3:2,故D错误,
故选C.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


科目:高中化学 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废钢渣和稀硫酸共网作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________。

(2)从辉铜矿中浸取铜元素时,可用FeC13溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是__________。
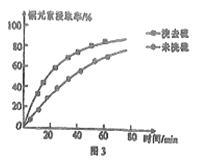
(3)“萃取”时,两种金属离子萃取率与PH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是__________。

(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为__________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_______、干燥、_____等操作可得到Fe2O3产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:2LaC13+6NH4HCO3= La2(CO3)3↓+6NH4Cl+ 3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
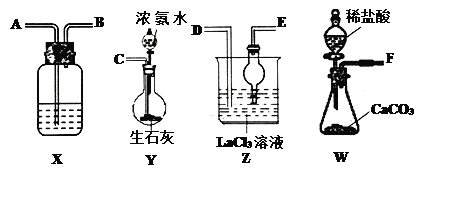
(l)盛放稀盐酸的仪器名称为____________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→___→___ →___ →___ →___ 。
(3)Y中发生反应的化学反应式为________________。
(4)X中盛放的试剂是_____,其作用为________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________。
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为_______;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为_______________________。
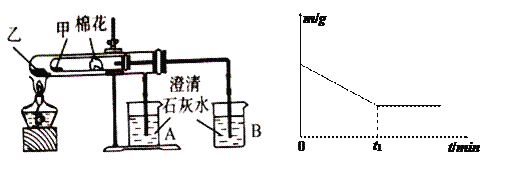
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或描述中错误的是( )。
A.将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体
B.溶剂蒸发的速度越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大
C.海带中碘元素的分离及检验时,需要向海带灰的浸取液中,加入少量稀硫酸和过氧化氢溶液
D.纸层析法分离铁离子和铜离子实验中,点样后的滤纸需晾干后,才能将其浸入展开剂中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( ) 
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应:CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的总能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物中间体M的流程图如下。

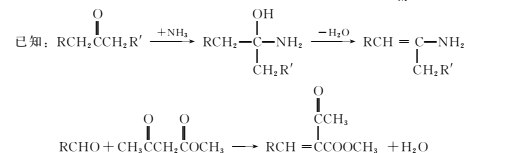
(1)芳香烃A的核磁共振氢谱有 ___种峰。
(2)在一定条件下,步骤②的化学方程式是____。
(3)步骤③反应物C含有官能团的名称是氨基、____。
(4)步骤④⑤⑥中,属于取代反应的是 ___(填序号)。
(5)步骤⑥可得到一种与G分子式相同的有机物,将其结构简式补充完整:____________
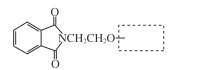
(6)H的结构简式是____。
(7)将步骤⑧中合成M的化学方程式补充完整:________
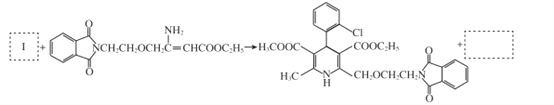
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是;(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称). 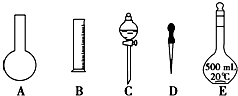
(2)配制NaOH时,在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”、“等于”或“小于”).
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所得配得溶液浓度0.5mol/L(填“大于”、“等于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带灰中提取碘的操作过程中仪器选用不正确的是
A. 称取3 g左右的干海带——托盘天平
B. 灼烧干海带至完全变成灰烬——蒸发皿或坩埚
C. 过滤煮沸后的海带灰和水的混合物——漏斗
D. 用四氯化碳从氧化后的海带灰浸取液中提取碘——蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物仅由C,H,O三种元素组成,其相对分子量小于150,若其中氧的质量分数为百分之50,则分子中C原子个数最多为( )
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com