
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,2.24 L水中所含电子总数为NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA
C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA
D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学 题型十 粒子变化型专题练习卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1NaOH溶液 | pH=11 NaOH溶液 | 0.1mol·L-1 CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型五 物质结构型专题练习卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
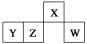
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液显酸性
C.最简单气态氢化物的热稳定性:Z>W
D.X与氢元素组成的化合物XH5与水反应可产生两种气体
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型九 速率平衡型专题练习卷(解析版) 题型:选择题
某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g)  CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是( )
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是( )
A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1
B.达平衡时压强变为原来的7/6
C.此温度下该反应的平衡常数为0.012 5
D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型三 NA应用型专题练习卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.9.2 g NO2气体中含有分子数目为0.2NA
B.标准状况下,2.24 L SO3中含有氧原子数目为0.3NA
C.2 g 中含中子、质子、电子数目均为NA
中含中子、质子、电子数目均为NA
D.标准状况下2.24 L Cl2通入足量水中或NaOH溶液中,转移电子数目均为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型三 NA应用型专题练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2晶体中含有0.4NA个离子
D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型七 网络构建型专题练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下不能实现的是( )
①Na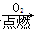 Na2O2
Na2O2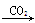 Na2CO3
Na2CO3
②MgO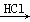 MgCl2溶液
MgCl2溶液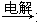 Mg
Mg
③Fe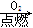 Fe2O3
Fe2O3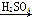 Fe2(SO4)3
Fe2(SO4)3
④SiO2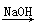 Na2SiO3
Na2SiO3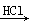 H2SiO3
H2SiO3
⑤HCHO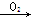 HCOOH
HCOOH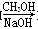 HCOOCH3
HCOOCH3
A.①②③ B.②③④ C.②③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学训练2.2.2分子空间构型分子性质练习卷(解析版) 题型:选择题
某化合物的分子式为AB2,该分子是否为极性分子取决于( )。
A.键的极性 B.键的空间排列
C.键的极性和空间排列 D.都不是
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(解析版) 题型:填空题
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________。
(2)根据等电子原理,写出CO分子的结构式________________________ ________________________________________________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是____________;1 mol甲醛分子中σ键的数目为________。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________。
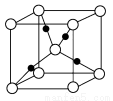
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com