
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+
B.2L0.5mol/L Na2SO4溶液中的Na+数目为2NA
C.1.00 mol NaCl中含有NA个NaCl分子
D.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体型分子且键角都为109.5°
C.NH4+的电子式为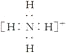 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)F2通入稀NaOH溶液中可生成OF2,OF2立体构型为___,其中氧原子的杂化方式为___。
(2)X、Y、Z、R为前四周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。XY2-的立体构型是___;X与Z形成化合物中含有的化学键是___、R2+的水合离子中,提供孤电子对的原子是___。
(3)ClO3-的立体构型为___(用文字描述,下同);CO32-的立体构型是__。
(4)在BF3分子中:F—B—F的键角是___,B原子的杂化轨道类型为__,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___。
(5)用价层电子对互斥理论推断,SnBr2分子中Sn—Br键的键角___(填“>”“<”或“=”)120°。其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观的描述化学反应的进程或结果。下列图像描述正确的是:
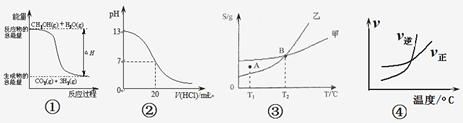
A.根据图①可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的ΔH<0
B.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液的pH随加入酸体积的变化
C.根据图③(S表示溶解度),A点表示T1℃时甲为饱和溶液,乙溶液未饱和。
D.根据图④可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氟磷酸锂(LiPO2F2)作为电解液添加剂能够有效提升锂电池的循环性能。在氮气气氛下,在PFA(全氟烷氧基树脂)烧瓶中加入高纯LiPF6和Li2CO3固体,以碳酸二甲酯作溶剂制备LiPO2F2,其流程如下:
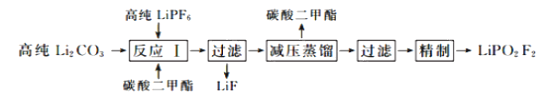
已知:LiPF6是一种白色结晶或粉末,潮解性强,遇水发生反应如下:LiPF6+H2O![]() LiF+POF3↑+2HF↑
LiF+POF3↑+2HF↑
(1)反应Ⅰ需要控制在60℃的条件下进行,适宜的加热方式为_____________。
(2)反应Ⅰ中有一种无色无味的气体生成,该气体的电子式为_______________。反应Ⅰ的化学方程式为______________________________________。
(3)高纯LiPF6需要控制适当过量的原因可能是_____________________________。 LiPO2F2制备过程中不采用玻璃仪器的原因是____________________________。
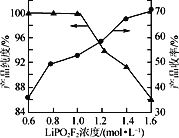
(4)保持其他实验条件都不变,在精制过程中加入提纯溶剂(杂质和LiPO2F2均可溶解在提纯溶剂中),LiPO2F2在提纯溶剂中的浓度对产品纯度和收率(收率=![]() ×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
(5)已知:常温下,碳酸锂微溶于水,碳酸氢锂可溶于水。工业级碳酸锂中含有少量难溶于水且与CO2不反应的杂质。请设计从工业级碳酸锂制备高纯碳酸锂的实验方案。(实验中须使用的试剂有:去离子水,CO2气体;除常用仪器外须使用的仪器:恒温水浴锅、真空干燥箱)__________
(6)已知碳酸锂Ksp=8.6×10-4,向浓度为0.2mol·L-1的硫酸锂溶液中加入等体积的碳酸钠溶液产生沉淀,则所加碳酸钠溶液的最低浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系分别如图一、图二所示。
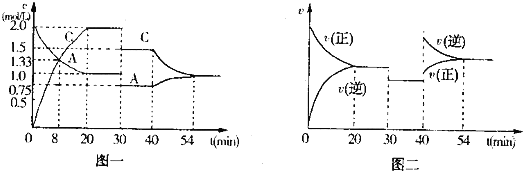
请回答下列问题:
(1)020min,A的平均反应速率为___mol/(Lmin);8min时,v(正)___v(逆)。(填“>”“=”或“<”)
(2)30min时改变的反应条件是___.
(3)40min时改变的条件是升高温度,则该反应的正反应为___(填“吸热”或“放热”)反应。
(4)能判断该反应是否达到化学平衡状态的依据是______(多项选择)。
a.容器内压强不变 b.混合气体中c(A)不变
c.v正(A)=v逆(B) d.c(A)=c(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物的热稳定性:W>R
C.WX3和水反应生成的化合物是离子化合物
D.X元素在自然界中存在同素异形现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com