
【题目】关于氨的下列叙述中,不正确的是( )
A.液氨是纯净物
B.实验室制氨气的方法是加热NH4Cl
C.氨易液化,因此可用来作制冷剂
D.氨极易溶于水,因此可用来作喷泉实验
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.非金属元素之间构成的化合物都不是离子化合物
B.阴、阳离子通过静电引力所形成的化学键叫离子键
C.离子化合物中一定没有共价键
D.含有阳离子的化合物一定含有阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机化学反应中,通常把有机物分子中失去氢原子或加入氧原子的反应叫做氧化反应,反之叫做还原反应。工处生产苯乙烯是利用乙苯的脱氢反应:![]() (正反应吸热)。针对上述反应,在其它条件不变时,下列说法正确的是
(正反应吸热)。针对上述反应,在其它条件不变时,下列说法正确的是
A. 该反应属于还原反应 B. 乙苯分子式C8H11
C. 苯乙烯最多16个原子共平面 D. 此逆反应不属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醇(沸点:197.3℃)是一种重要的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反应II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
请回答下列问题:
(1)煤基合成气间接合成乙二醇的总热化学方程式是_____________________________,已知该反应在较低温条件下能自发进行。说明该反应的△H ______0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时CO的体积分数与NO的体积分数相等,计算该反应的化学平衡常数K=_____________。若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂的活性参数——空时收率和CO的选择性可表示如下:
空时收率=CH3OOCCOOCH3质量/反应时间×催化剂的体积
CO的选择性=合成[CH3OOCCOOCH3所消耗的CO的物质的量/反应掉的CO的物质的量]×100%
在不同温度下,某学习小组对四组其他条件都相同的反应物进行研究,经过相同时间th,测得空时收率、CO的选择性数据如下表所示。
反应温度(℃) | 空时收率(g·mL-1·h-1) | CO的选择性(%) |
130 | 0.70 | ①72.5 |
140 | 0.75 | ②71.0 |
150 | 0.71 | ③55.6 |
160 | 0.66 | ④63.3 |
下列说法正确的是________(填字母代号)。
A.温度升高,空时收率先增大后减小,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低
C.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
D.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
(4)120℃、常压时,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
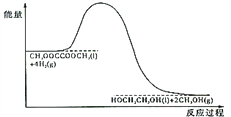
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A在一定条件下可以转化为有机物E,其转化关系如下图。已知烃A在标准状况下的密度为116g/L,加热时B与新制氢氧化铜产生砖红色沉淀,E为有浓郁香味、不易溶于水的油状液体。
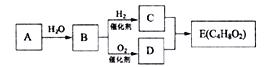
请回答:
(1)B中官能团的结构简式为_________________________。
(2)C+D→E的化学方程式为___________________________________。
(3)下列说法正确的是______
a.C物质与金属钠反应比水与金属钠反应更剧烈
b.有机物C、D、E可用饱和Na2CO3溶液鉴别
c.实验室制备E时,加入浓盐酸做催化剂
d.B能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
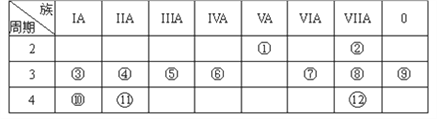
(1)写出元素符号:⑨________(填化学式,下同)
(2)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,呈两性的氢氧化物是________。
(4)写出③和⑧形成的化合物的电子式__________________。
(5)写出④和⑧所构成的化合物的化学键类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”为中国化工企业开辟了新的国际市场,而能源、资源整合及环境治理是保驾护航的基础。
Ⅰ.在能源领域,科学家提出“绿色自由“”构想: 把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
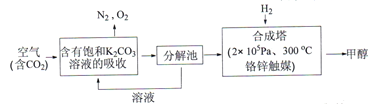
(1)在合成塔中,若有4400gCO2与足量H2完企反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式__________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:
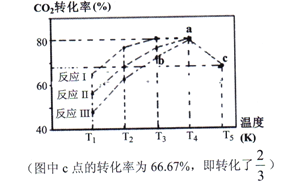
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c点时该反应的平衡常数K =_________。(写单位)
Ⅱ.环境治理中,安装汽车尾气催化转化器的反应是:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)温度升高K值_______(填“增大”或“减小”)
(4)若反应在恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。

(5)下列所示装置可以在吸收SO2的同时,用阴极排出的溶液吸收NO2,(电极均为惰性电极)

a极为______极(填“阴”、“阳”),b极的电极反应式为_________,结合电极反应式简述该装置能吸收SO2的原理:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com