
 .
.分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B元素氢化物的水溶液呈碱性,则B为N元素;A与D同主族且能形成离子化合物DA,则D为金属元素,A为非金属元素,所以D为Na元素、A为H元素;C与E同主族且EC2是一种具有刺激性气味的气体,C的原子序数小于E,所以EC2为SO2,则C为O元素,E为S元素,F的原子序数大于S,为短周期元素,F为Cl元素,结合元素化合物的性质及元素周期律解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B元素氢化物的水溶液呈碱性,则B为N元素;A与D同主族且能形成离子化合物DA,则D为金属元素,A为非金属元素,所以D为Na元素、A为H元素;C与E同主族且EC2是一种具有刺激性气味的气体,C的原子序数小于E,所以EC2为SO2,则C为O元素,E为S元素,F的原子序数大于S,为短周期元素,F为Cl元素;
(1)元素F为Cl,在周期表中的位置是:第三周期第ⅦA族,
故答案为:第三周期第ⅦA族;
(2)电子层越多原子半径越大,电子层数相同时,原子序数越大,原子半径越小,所以C、D、E三种元素原子半径由大到小的顺序为r(Na)>r(S)>r(O);氯气与NaOH反应生成NaCl和NaClO,其反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O;
故答案为:r(Na)>r(S)>r(O);2OH-+Cl2=Cl-+ClO-+H2O;
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,为NCl3,分子中N原子与Cl原子之间形成1对共用电子对,所以电子式为: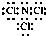 ;
;
故答案为: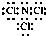 ;
;
(4)已知0.50mol SO2被O2氧化成气态SO3,放出49.15kJ热量,其热化学方程式为2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ•mol-1;
故答案为:2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ•mol-1;
(5)H、N、O以原子个数比4:2:3所形成的化合物为NH4NO3,所含的化学键类型为离子键和共价键;NH4NO3溶液中铵根离子水解溶液显酸性,铵根离子浓度减小,所以离子浓度大小关系为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);
故答案为:离子键、共价键;c(NO3-)>c(NH4+)>c(H+)>c(OH-).
点评 本题考查结构位置性质关系应用,涉及常元素周期律、盐类水解、元素化合物性质、热化学方程式的书写等,推断元素是解题关键,注意对基础知识的掌握.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 64g Cu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA | |
| B. | 足量的CO2与39gNa2O2发生反应转移的电子数为NA | |
| C. | 18g的D2O与NA个-CH3具有相同的电子数 | |
| D. | 6.0g醋酸晶体中含有H+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 春节燃放爆竹对环境无污染 | |
| B. | “酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 家庭用的“84”消毒液与洁厕灵可同时混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| B. | 明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
.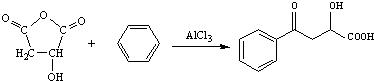 .
.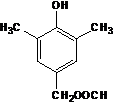 或
或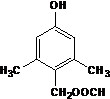 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠可用于制备纯碱、治疗胃酸过多的药剂 | |
| B. | 胃酸过多的人不宜吃海带、鸡肉、苹果等酸性食物 | |
| C. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 1mol葡萄糖能水解成2mol乙醇和2mol二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)、c(SO42-)均增大 | |
| B. | c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2 | |
| C. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)=Ksp(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | Fe3O4俗称铁红,可用作红色涂料 | |
| C. | Na2CO3俗称纯碱,可作为制造玻璃的原料 | |
| D. | KAl(SO4)2•12H2O俗称明矾,可作为净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com