
铜是人类认识并应用最早的金属之一,我国是最早使用铜器的国家之一。铁与人类生活密切相关,几乎无处不在,是地壳中含量仅次于铝的金属。某研究性学习小组为了证明铁的金属活动性比铜强,设计了如下实验方案:
(1)将铁片置于硫酸铜溶液中有铜析出
(2)铁、铜和氯气反应分别生成FeCl3和CuCl2
(3)足量的铁粉和铜粉与浓硫酸在加热条件下反应分别生成FeSO4和CuSO4
(4)将铜片置于FeCl3溶液中铜片逐渐溶解
(5)把铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接,铁片上无气泡产生,而铜片上有气泡产生
(6)把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生
以上实验方案设计合理的有( )
A.两种 B.三种
C.四种 D.五种
科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为
该反应在石英真空管中进行,如下图所示:

①反应(I)的平衡常数表达式K=_______,若K= ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的 ____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等.
(2)25℃时,NaHSO3的水解平衡常数=1.0×10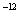 mol
mol ,则该温度下
,则该温度下
 的电离常数
的电离常数 =____mol
=____mol ,若向H2SO3溶液中加入少量的I2,则溶液中
,若向H2SO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:

当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第3周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
A.砷在通常情况下是固体
B.可以存在-3、+3、+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4弱
D.AsH3的稳定性比PH3强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是: ( )
A. 乙烷的一氯代物同分异构体有1种,二氯代物的同分异构体有3种
B. 丙烷的一氯代物同分异构体有2种,二氯代物的同分异构体有5种
C. 正丁烷的一氯代物同分异构体有2种,二氯代物的同分异构体有5种
D. 正戊烷的一氯代物同分异构体有3种,二氯代物的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上存在许多的递变关系,下列递变关系完全正确的是( )
A.离子半径:Na+>Mg2+>Al3+>Cl— ;原子半径:Na>Mg>Al>Cl
B.稳定性:HF>H2O>NH3>CH4 ; 还原性: HF < H2O < NH3< CH4
C.碱性:CsOH>KOH>Mg(OH)2>NaOH ; 金属性:Cs>K>Mg>Na
D.酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应2A(g) B(g)+D(g)在4种不同条件下进行(仅有一种条件不同),B和D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在4种不同条件下进行(仅有一种条件不同),B和D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)实验1从第________min后一定达到化学平衡,实验4比实验1反应速率快的原因主要是______________________。假定实验3反应进行了30min时恰好达到平衡,则从开始到平衡的平均反应速率为_________________。
(2)实验3比实验1的反应速率________(填“快”或“慢”),原因是____________________________________________。
(3)如果2A(g) B(g)+D(g)是一个放热反应,且容器的体积均为1L,那么实验4与实验1相比,________放出的热量多,理由是_________________________。
B(g)+D(g)是一个放热反应,且容器的体积均为1L,那么实验4与实验1相比,________放出的热量多,理由是_________________________。
(4)实验_______的反应速率最快,快的原因可能是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列涉及有机物的说法正确的是( )
A.互为同分异构体的物质化学性质一定不同
B.甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化
C.乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应
D.乙炔的化学性质与乙烯相似,也能形成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
以苯酚为原料的合成路线如下所示,部分试剂和反应条件已略去。请按要求作答:
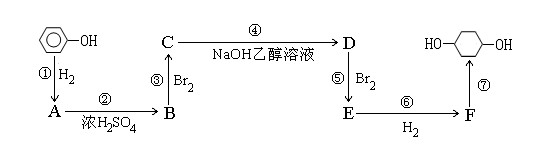
(1)写出以下物质的结构简式:
B: ; F: ;
(2)写出反应④⑤的化学反应方程式:
④
⑤
(3)在苯酚钠溶液中通入少量二氧化碳气体会出现浑浊,反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com