


科目:高中化学 来源: 题型:
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度 | 10℃ | 30℃ | 40℃ | 50℃ | 60℃ |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 80m-135n2 |
| 18n2 |
| 80m-135n2 |
| 18n2 |
查看答案和解析>>
科目:高中化学 来源:2012届江苏省涟水中学高三12月阶段性测试化学试卷(带解析) 题型:填空题
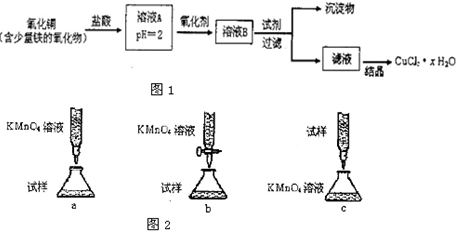
铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
方法一、还原法:
(Ⅰ)在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下: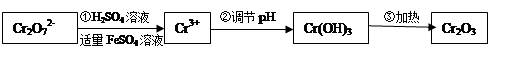
请回答下列问题:
(1)上述流程①发生反应的离子方程式是 。
(2)若在① 使FeSO4适当过量、空气适量,可产生具有磁性、组成类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物( ·y
·y O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物( ·y
·y O)化学式是 。
O)化学式是 。
(Ⅱ)研究发现,用铁粉作还原剂不仅可以除去Cr6+,还能除去废水中的少量Mn2+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,
(3)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 时锰、铬去除率最好
(4)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好

方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(5)写出此阴极反应的电极方程式 。
(6)现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省如皋中学高三10月阶段练习化学试卷(带解析) 题型:填空题
(15分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):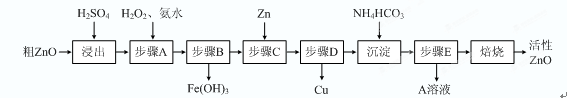
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:填空题
(15分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
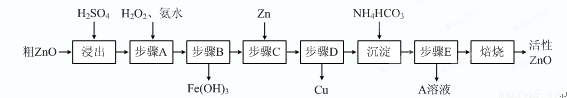
已知:几种离子生成氢氧化物沉淀时的pH如下表:
|
待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
|
开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
|
完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请问答下列问题:
⑴ 步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
⑵ A溶液中主要含有的溶质是 。
⑶ 碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是 。
⑷ 若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com