
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
���� ��1��Խ����ˮ����Σ�Խ����������ӣ���ͬŨ�ȵ�������Һ��pHԽ�����ε�ˮ��̶�Խ��Ũ����ͬ����ϡ����ͬ�ı���������Խǿ������pH�仯Խ��
��2�����������ˮ��͵���غ���������ע�������ˮ�������ģ�
��ʼ����ʱpHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ�����
��� �⣺��1��Խ����ˮ����Σ�Խ����������ӣ���ͬŨ�ȵ�������Һ��pHԽ�����ε�ˮ��̶�Խ����������ˮ�������̼���ƣ�����������������ӵ���������CO32-��Ũ����ͬ����ϡ����ͬ�ı���������Խǿ������pH�仯Խ��HCN��HClO��CH3COOH��H2CO3����������Դ�С˳����CH3COOH��H2CO3��HClO��HCN��������Һ��pH�仯�����Ǵ��ᣬ��ѡC��
�ʴ�Ϊ��CO32-��C��
��2��300mL 1mol•L-1��NaOH�����ʵ���=1mol/L��0.3L=0.3mol����״����4.48LCO2�����ʵ���=$\frac{4.48L}{22.4L/mol}$=0.2mol�������������ƺͶ�����̼��Ӧ����ʽΪ2CO2+3NaOH=Na2CO3+NaHCO3+H2O����Һ��̼�������ˮ���ʹ��Һ�ʼ��ԣ���C��OH-����C��H+����̼�������ˮ������̼��������ӣ�����C��HCO3-����C��CO32-��������ˮ��̶Ƚ�С������C��CO32-����C��OH-��������Һ�и�����Ũ�ȴ�С˳����C��Na+����C��HCO3-����C��CO32-����C��OH-����C��H+����
pHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ���������Cu2+�ȳ�����KSP[��Fe��OH��2]��KSP[��Mg��OH��2]��
�ʴ�Ϊ��C��Na+����C��HCO3-����C��CO32-����C��OH-����C��H+����Cu2+������
���� ���⿼����������ʵĵ��롢�ε�ˮ�⡢����Ũ�ȵıȽϡ�Ksp��Ӧ�õ�֪ʶ�㣬��Ŀ�����֪ʶ��϶࣬��Ŀ�Ѷ��еȣ�ע�������Һ������Ũ�ȴ�С�Ƚϵķ�����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������ѻ����͡��屽���������� | |
| B�� | �Ҵ������ᡢ��ȩ���ұ� | |
| C�� | ��������Һ�����͡��ױ������� | |
| D�� | ���ӡ�����ϩ������1��2-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X��Y��Z | B�� | Y��X��Z | C�� | Y��Z��X | D�� | Z��Y��X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
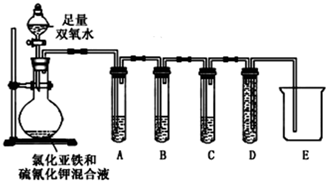
| ʵ����̺����� | ���� |
| ��2���Թ�A��ʢ��Ʒ����Һ������ Ʒ����Һ��ɫ | ֤�������к���SO2 |
| ��2���Թ�B��������ɫ���Ը��������Һ��ɫ������dz ���Թ�C������������ʯ��ˮ����� | ֤�������к���CO2 |
| ʵ����� | ʵ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
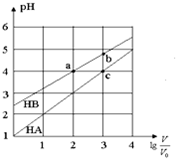 �����£�Ũ�Ⱦ�Ϊ0.10mol/L�������ΪV0��HA��HB��Һ���ֱ��ˮϡ�������V��pH��$lg\frac{V}{V_0}$�ı仯��ͼ��ʾ������������ȷ���ǣ�������
�����£�Ũ�Ⱦ�Ϊ0.10mol/L�������ΪV0��HA��HB��Һ���ֱ��ˮϡ�������V��pH��$lg\frac{V}{V_0}$�ı仯��ͼ��ʾ������������ȷ���ǣ�������| A�� | ���¶���HB�ĵ���ƽ�ⳣ��Լ����1.11��10-5 | |
| B�� | ��ͬ������NaA��Һ��pH����NaB��Һ��pH | |
| C�� | ��Һ��ˮ�ĵ���̶ȣ�a=c��b | |
| D�� | ��$lg\frac{V}{V_0}=3$ʱ��������Һͬʱ�����¶ȣ���$\frac{{c��{B^-}��}}{{c��{A^-}��}}$��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
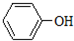 �����б����ϵ�һ���ⱻ-C3H7ԭ����ȡ���γɵ��л��ﹲ�У�������
�����б����ϵ�һ���ⱻ-C3H7ԭ����ȡ���γɵ��л��ﹲ�У�������| A�� | 15�� | B�� | 12�� | C�� | 9�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Mn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
| ��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
| ��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ۢ� | C�� | �ۢܢ� | D�� | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com