
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_____。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为_____________。
(4)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(5)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(6)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
【答案】 64 30 g·mol-1 44 g·mol-1 24 ![]() 6.4 mol 0.2 mol
6.4 mol 0.2 mol
【解析】(1).根据标况下的体积计算气体的物质的量,再利用质量和物质的量计算出摩尔质量及相对分子量;(2).根据同温同压下气体的体积之比等于物质的量之比计算;(3).根据同温同体积时,气体的压强之比等于物质的量之比进行计算;(4). 由n=![]() 及氯化物的构成,利用离子的物质的量列式计算;(5).由铁离子的质量求出铁离子的物质的量,根据化学式计算硫酸根离子的物质的量,再除以溶液的体积得硫酸根离子的物质的量浓度;(6). 在配制的溶液中,钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量。
及氯化物的构成,利用离子的物质的量列式计算;(5).由铁离子的质量求出铁离子的物质的量,根据化学式计算硫酸根离子的物质的量,再除以溶液的体积得硫酸根离子的物质的量浓度;(6). 在配制的溶液中,钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量。
(1). 标准状况下,672mL气体的物质的量为n=![]() =0.03mol,气体的摩尔质量为M=1.92g÷0.03mol=64g/mol,该气体的相对分子量为64,故答案为:64;
=0.03mol,气体的摩尔质量为M=1.92g÷0.03mol=64g/mol,该气体的相对分子量为64,故答案为:64;
(2). 在同温同压下,气体的体积之比等于物质的量之比,即CH4和A气体的物质的量之比为15∶8,设二者质量均为a g,则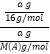 =
=![]() ,解得M(A)=30 g·mol-1,故答案为:30 g·mol-1;
,解得M(A)=30 g·mol-1,故答案为:30 g·mol-1;
(3). 在同温同体积时,气体的压强之比等于物质的量之比,即A和CH4气体的物质的量之比为4∶11,则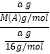 =
=![]() ,解得M(A)=44 g·mol-1,故答案为:44 g·mol-1;
,解得M(A)=44 g·mol-1,故答案为:44 g·mol-1;
(4). 二价金属的氯化物RCl2中含有0.4 mol的Cl-,则RCl2的物质的量为n(RCl2)=![]() =0.2mol,其摩尔质量为M(RCl2)=
=0.2mol,其摩尔质量为M(RCl2)=![]() =95g/mol,则R的相对原子质量为95-35.5×2=24,故答案为:24;
=95g/mol,则R的相对原子质量为95-35.5×2=24,故答案为:24;
(5). V L Fe2(SO4)3溶液中含Fe3+ m g,则n(Fe3+)=![]() =
=![]() mol,根据硫酸铁的化学式可知SO42-的物质的量为n(SO42-)=
mol,根据硫酸铁的化学式可知SO42-的物质的量为n(SO42-)=![]() ×n(Fe3+)=
×n(Fe3+)=![]() ×
×![]() mol,则SO42-的物质的量浓度为c(SO42-)=
mol,则SO42-的物质的量浓度为c(SO42-)=![]() =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(6).在无土栽培中,配制1L含5mol NH4CI、1.6mol KCl、2.4mol K2SO4的某营养液,该营养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol,需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol-6.4mol=0.2mol,故答案为:6.4mol;0.2mol。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】将充有m mLNO 和n mLNO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分反应后量筒内气体体积(mL)为( )
A. 3(m-n)B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D,回答下列问题:
D,回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则
①写出实验室制取A的化学方程式:______________________________________;
②写出由A生成B的化学方程式:______________________________________;
③某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因:_____________________________________________。
(2)若A与B反应能生成一种淡黄色固体单质,写出该反应的化学方程式:_______________________。
(3)若A是金属单质,C是一种淡黄色固体,写出C生成D的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA
B. 标准状况下,22.4 L NO2气体中所含分子数目为NA
C. 100 g 17%的氨水,溶液中含有的NH3分子数小于NA
D. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
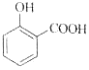 +2HCO3-→
+2HCO3-→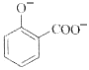 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是
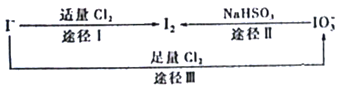
A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)由1H216O与2H217O所代表的物质中,共有__________种元素,_________种原子,16O、17O的关系为________。
(2)红热木炭放入浓硫酸产生气体过程的化学反应方程式______________________。
(3)硫酸型酸雨产生的原因________________________________(化学方程式)
(4)SO2通入酸性高锰酸钾溶液中的离子方程式____________________________
(5)现有2.96 g铁的硫化物在空气中完全反应,生成2.40 g红色粉末(Fe2O3),并放出有刺激性气味的气体。将该气体通入溴水中,溶液褪色。用离子方程式表示溴水褪色的原因:___________________;通过计算,该铁的硫化物化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中广泛涉及氧化还原反应
Ⅰ.研究电化学腐蚀及防护的装置如图所示
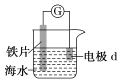
(1)若d为石墨,石墨上的电极反应式为_________________ ;
(2)若d为锌,锌上的电极反应式为___________________;
(3)将图中电流表换成外接电源,铁片接___________(填“正”或“负”)极被保护
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2![]() 2Na2FeO4+2Na2O+2Na2SO4+O2↑
2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是________________,还原剂是_______________,每生成1 molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用_________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________。
②每生成1 mol FeO42-转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com