
科目:高中化学 来源: 题型:
在一定量的密闭容器中进行反应:N2(g)+3H2 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是
A.N2为0.2 mol/L,H2为0.6 mol/L B.N2为0.15 mol/L
C.N2、H2均为0.18 mol/L D.NH3为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。实验所用仪器如下:

(1)写出发生装置中进行反应的化学方程式: ;
(2)上述仪器的连接顺序是(填接口字母):E接 , 接 , 接 , 接 。
(3)实验前,应该进行的一项操作是 。
(4)饱和食盐水的作用是 。
(5)若实验中得到标况下11.2L氯气,被氧化的HCl的物质的量为 ,此时转移的电子数是 。
(6)下列试剂中,可以用来吸收残余氯气的是 。
A.饱和食盐水 B.氢氧化钠溶液 C.碳酸钠溶液 D.浓硫酸
(7)工业上制取氯气的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与有机化合物结构、性质有关的叙述正确的是
A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应
B.甲烷和苯都既能发生取代反应,又能使酸性KMnO4溶液退色
C.乙醇和乙酸分子中都含羟基,都既能与Na反应,又能与NaOH溶液反应
D.甲苯可与浓硝酸在一定条件下发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组为制备消毒液(主要成分是NaClO)设计了下列装置,并查阅到下列资料:在加热情况下氯气和碱溶液能发生如下反应:
 3Cl2 + 6OH—5Cl— + ClO3— + 3H2O
3Cl2 + 6OH—5Cl— + ClO3— + 3H2O

请回答下列问题:
(1)连接好装置,装药品之前,必须进行的一项操作步骤是____________________。
(2)圆底烧瓶内发生反应的化学方程式为_____________________________________;大试管内发生反应的离子方程式为__________________________________________。
(3)饱和食盐水的作用是_________________________________;冰水的作用是______
___________________________。
(4)在制取Cl2时,实验室中若无MnO2,可用KMnO4粉末代替,发生下列反应:
2KMnO4 + 16HCl(浓)= 2MnCl2 + 2KCl + 5Cl2↑+ 8H2O
则可选择的发生装置是(填序号)___________。
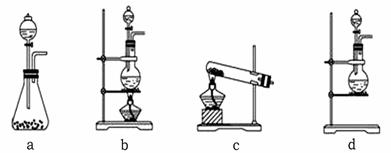
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法中,不正确的是 



A.液化石油气和天然气的主要成分都是甲烷
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2悬浊液可检验尿液中的葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为元素周期表短周期的一部分。关于A~G 七种元素的叙述正确的是
A.E、F、G形成的单质中都含有共价键
B.形成的简单阴离子半径:E > C > D
C.B、C、D三种元素的氢化物的稳定性依次减弱
D.A、B、E的氢化物都能跟HNO3 发生化合反应

查看答案和解析>>
科目:高中化学 来源: 题型:
氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1+ Q2<2Q3 B.Q1+ Q2>2Q3
C.Q1+ Q2<Q3 D.Q1+ Q2>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
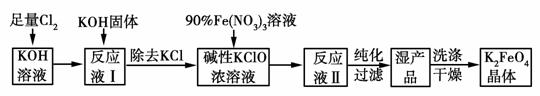
已知:2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)将Cl2通入KOH溶液中发生反应的离子方程式是_________。
(2)写出工业上制取Cl2的化学方程式__________________。
(3)在“反应液Ⅰ”中加入KOH固体的目的是_________。
(4)K2FeO4可作为新型多功能水处理剂的原因是_____________。
(5)配制KOH溶液时,将61.6 g KOH固体完全溶解在100 mL水中,所得溶液的密度为1.47 g·mL-1,则该溶液的物质的量浓度为__________________。
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是________、________(写化学式)。
(7)该工艺每得到1.98 Kg K2FeO4,理论上消耗Cl2的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com