
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、7.8gNaS和 Na2O2中含有的阴离子数等于0.1NA |
| C、50mL18.4mol L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
| 1 |
| 2 |
| 46g |
| 46g/mol |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 | 若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中滴加 |
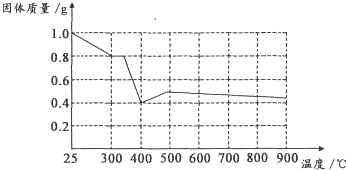
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质、葡萄糖和乙酸均属电解质 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| U | ||
| Y |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入He的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN显红色的溶液:K+、NH+4、Cl-、S2- |
| B、“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
| C、pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
| D、无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①③④ | B、①②③④ |
| C、③②①④ | D、②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
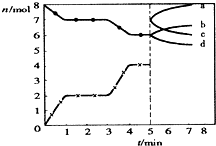 高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )
高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )A、2min时,
| ||||
| B、0~lmin,v(CO)=1 mol/(L?min);1~3min时,v(CO)=v(CO2) | ||||
| C、3min时温度由T1升高到T2,则x>O | ||||
| D、5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com