
| Ń”Ļī | ŹµŃéĻÖĻó»ņŹĀŹµ | ½āŹĶ |
| A | ¼ģŃé“ż²āČÜŅŗÖŠSO42-£¬ĻȵĪČėĻ”ŃĪĖį£¬ŌŁµĪČėBaCl2ČÜŅŗ | ĻȵĪČėŃĪĖįæÉÅųżAg+”¢CO3-”¢SO32-µČĄė×ÓøÉČÅ |
| B | ĀĮ²²åČėĻ”ĻõĖįÖŠ | ĀĮ²±ķĆę±»HNO3Ńõ»ÆŠĪ³ÉÖĀĆܵÄŃõ»ÆĤ |
| C | ĻņFe£ØNO3£©2ČÜŅŗÖŠ¼ÓČėĻ”ĮņĖį£¬ŹŌ¹ÜæŚÓŠŗģ×ŲÉ«ĘųĢå²śÉś | ČÜŅŗÖŠNO3-±»Fe2+»¹ŌĪŖNO2 |
| D | ŗ¬Mg£ØHCO3£©2µÄÓ²Ė®³¤Ź±¼ä³ä·Ö¼ÓČČ£¬×īÖÕµĆµ½µÄ³ĮµķĪļµÄÖ÷ŅŖ³É·ÖĪŖMg£ØOH£©2¶ų²»ŹĒMgCO3 | Kap£ØMgCO3£©£¼Kap[Mg£ØOH£©2] |
| A£® | A | B£® | B | C£® | C | D£® | D |
·ÖĪö A£®¼ÓŃĪĖįÅųżøÉČÅĄė×Ó£»
B£®ĀĮÄܹ»ČÜÓŚĻ”ĻõĖį£»
C£®ĻņFe£ØNO3£©2ČÜŅŗÖŠ¼ÓČėĻ”ĮņĖį£¬ĻõĖįøłĄė×ÓŌŚĖįŠŌĢõ¼ž¾ßÓŠĒæŃõ»ÆŠŌ£»
D£®×īÖÕµĆµ½µÄ³ĮµķĪļµÄÖ÷ŅŖ³É·ÖĪŖMg£ØOH£©2£¬¶ų²»ŹĒMgCO3£¬ĒāŃõ»ÆĆ¾øüÄŃČÜ£®
½ā“š ½ā£ŗA£®¼ÓŃĪĖįÅųżøÉČÅĄė×Ó£¬ŌŁµĪČėBaCl2ČÜŅŗ£¬Éś³É°×É«³ĮµķæɼģŃéĮņĖįøłĄė×Ó£¬¹ŹAÕżČ·£»
B£®ĀĮÓėÅØĻõĖį·¢Éś¶Ū»Æ·“Ó¦£¬µ«ČÜÓŚĻ”HNO3£¬¹ŹB“ķĪó£»
C£®ĻņFe£ØNO3£©2ČÜŅŗÖŠ¼ÓČėĻ”ĮņĖį£¬ĻõĖįøłĄė×ÓŌŚĖįŠŌĢõ¼ž¾ßÓŠĒæŃõ»ÆŠŌ£¬ŌņČÜŅŗÖŠNO3-±»Fe2+»¹ŌĪŖNO£¬Č»ŗóNO±»Ńõ»ÆÉś³ÉNO2£¬¹ŹC“ķĪó£»
D£®×īÖÕµĆµ½µÄ³ĮµķĪļµÄÖ÷ŅŖ³É·ÖĪŖMg£ØOH£©2£¬¶ų²»ŹĒMgCO3£¬ĒāŃõ»ÆĆ¾øüÄŃČÜ£¬ŌņKw£ØMgCO3£©£¾Kw[Mg£ØOH£©2]£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é»ÆѧŹµŃé·½°øµÄĘĄ¼Ū£¬ĪŖøßĘµæ¼µć£¬Éę¼°Ąė×ӵļģŃ锢Ńõ»Æ»¹Ō·“Ó¦”¢ĪļÖŹÖʱøŹµŃéµČ£¬°ŃĪÕŹµŃéŌĄķ”¢ŹµŃé²Ł×÷ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | F-µÄ½į¹¹Ź¾ŅāĶ¼£ŗ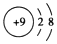 | |
| B£® | ÖŠ×ÓŹżĪŖ20µÄĀČŌ×Ó£ŗ${\;}_{17}^{20}$Cl | |
| C£® | S2-µÄ½į¹¹Ź¾ŅāĶ¼£ŗ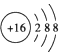 | |
| D£® | Ō×ÓŗĖÄŚÓŠ18øöÖŠ×ÓµÄĀČŌ×Ó£ŗ${\;}_{17}^{35}$Cl |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2ŗĶNO2ŹĒÖ÷ŅŖµÄ“óĘųĪŪČ¾Īļ | |
| B£® | “óĘųÖŠµÄSO2ŗĶCO2ČÜÓŚĖ®ŠĪ³ÉĖįÓź | |
| C£® | ŅŌŅŗ»ÆŹÆÓĶĘų“śĢęČ¼ÓĶæɼõÉŁ“óĘųĪŪČ¾ | |
| D£® | ¶ŌĆŗČ¼ÉÕŗóŠĪ³ÉµÄŃĢĘųĶŃĮņ£¬ÄæĒ°Ö÷ŅŖÓĆŹÆ»Ņ·Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
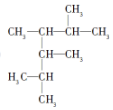 2£¬3£¬4£¬5-Ėļ׻ł¼ŗĶé
2£¬3£¬4£¬5-Ėļ׻ł¼ŗĶé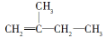 2-¼×»ł-1-¶”Ļ©
2-¼×»ł-1-¶”Ļ©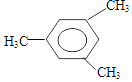 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 µ±Ē°ĒéæöĻĀÉ¢ÉÕĆŗŗĶƻӊĒå½ąµÄĆŗŹĒŌģ³ÉÖŠ¹ś³ĒŹŠĪķö²»ņÕ߶«²æĪķö²µÄÖ÷ŅŖŌŅņ£¬ĆŗµÄĘų»ÆŹĒ½ā¾öĪķö²£¬Ēå½ąµŲĄūÓĆĆŗĢæµÄÖŲŅŖĶ¾¾¶Ö®Ņ»£®
µ±Ē°ĒéæöĻĀÉ¢ÉÕĆŗŗĶƻӊĒå½ąµÄĆŗŹĒŌģ³ÉÖŠ¹ś³ĒŹŠĪķö²»ņÕ߶«²æĪķö²µÄÖ÷ŅŖŌŅņ£¬ĆŗµÄĘų»ÆŹĒ½ā¾öĪķö²£¬Ēå½ąµŲĄūÓĆĆŗĢæµÄÖŲŅŖĶ¾¾¶Ö®Ņ»£®| ĪļÖŹ | H2£Øg£© | C£Øs£© | CO£Øg£© |
| Č¼ÉÕČČKJ/mol | 285.8 | 393.5 | 283.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
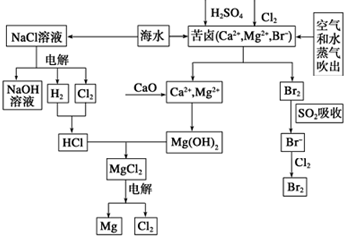 ŗ£Ė®ŹĒ±¦¹óµÄ׏Ō“±¦æā£¬ÄæĒ°ĀČ¼ī¹¤Ņµ”¢ŗ£Ė®ĢįĆ¾”¢ŗ£Ė®ĢįäåĪŖČĖĄąĢį¹©ĮĖ“óĮ湤ŅµŌĮĻ£®ĻĀĶ¼ŹĒŗ£Ė®×ŪŗĻĄūÓĆµÄ²æ·ÖĮ÷³ĢĶ¼£¬¾ŻĶ¼»Ų“šĪŹĢā£ŗ
ŗ£Ė®ŹĒ±¦¹óµÄ׏Ō“±¦æā£¬ÄæĒ°ĀČ¼ī¹¤Ņµ”¢ŗ£Ė®ĢįĆ¾”¢ŗ£Ė®ĢįäåĪŖČĖĄąĢį¹©ĮĖ“óĮ湤ŅµŌĮĻ£®ĻĀĶ¼ŹĒŗ£Ė®×ŪŗĻĄūÓĆµÄ²æ·ÖĮ÷³ĢĶ¼£¬¾ŻĶ¼»Ų“šĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| »ÆѧŹ½ | CH3COOH | H2CO3 | H2SO3 |
| µēĄėĘ½ŗā³£ŹżK | K=1.8”Į10-5 | K1=4.3”Į10-7 K2=5.6”Į10-11 | K1=1.5”Į10-2 K2=1.02”Į10-7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com