
下列实验正确的是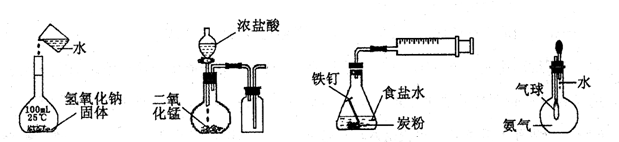
| A.配制一定浓度溶液 | B.制取并收集Cl2 | C.铁的析氢腐蚀 | D.验证氨气易溶于水 |
D
解析试题分析:配制一定浓度溶液时,图中代表的是移液步骤的操作,不能直接将烧杯中的NaOH溶液倒入100mL容量瓶中,必须使用玻璃棒引流,故A项错误;制取并收集氯气时,应根据反应物的状态和反应条件决定制取方法和装置,根据气体的性质确定收集方法,二氧化锰固体和浓盐酸混合加热才能反应,图中缺少酒精灯等加热用品,氯气的密度比空气大,不能用向下排空气法收集,因此图中短进长出排空气不能收集氯气,应改为长进短出排空气,故B项错误;铁比碳活泼,铁是负极,碳是正极,NaCl是强酸强碱盐,其溶液显中性,因此铁钉发生吸氧腐蚀,不能发生析氢腐蚀,故C项错误;若气球体积快速或明显增大,说明大气与瓶内气体存在较大的压强差,原因只能是瓶内气体体积迅速减小,说明氨气极易溶于水,故D项正确。
考点:考查化学实验装置图的设计与评价,涉及配制一定浓度溶液、实验室制取并收集氯气、钢铁的吸氧腐蚀和析氢腐蚀、氨气的溶解性实验等。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:单选题
(双选)下列实验方法正确的是
| A.用无水乙醇提取碘水中的碘单质 |
| B.加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42- |
| C.可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液 |
| D.玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀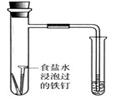 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备流程如下: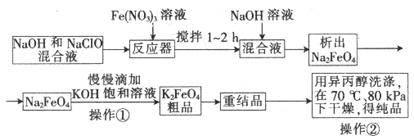
试回答下列问题
(1)反应器中,NaOH、NaClO、Fe(NO3)3发生反应生成Na2FeO4,完成并配平下列离子反应方程式:
□Fe3++□ClO─+□OH─ ==□FeO42─+□Cl─+□___________
(2)次氯酸钠浓度对高铁酸钾产率有一定影响,当NaClO浓度为298g/L时,高铁酸钠的产率最高,此时NaClO的物质的量浓度为_______________。
(3)你认为操作①能够发生转化的原因是__________,慢慢滴加的原因的是___________。
(4)操作②如果温度过高会造成高铁酸钾的分解,高铁酸钾受热分解时生成金属氧化物和氧气,该反应的化学方程式为__________________。
(5)可以用电化学法制取Na2FeO4,其装置如图所示,则阳极的电极反应式为 ;
阴极的电极反应式为______________;电解一段时间后溶OH─的浓度会_________(填“升高”、“降低”
或“不变”)。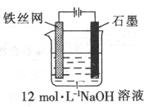
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油。
资料一 石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态。
资料二 石油催化裂化中通常使用Al2O3作催化剂。
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。
(1)该装置仪器连接的顺序应遵循的原则为__________________,
为保证实验成功,实验前必须进行的操作是_________________,
装置中较长导管的作用是_____________________。
(2)试管Ⅱ中少量液体凝结说明了______。
(3)试管Ⅲ中溶液褪色说明了________________。
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是_______________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式________________。
(6)石油裂化的重要意义是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样中的COD。主要的实验装置、仪器及具体操作步骤如下:
实验装置及仪器:
操作步骤:
①用仪器c将20.00mL水样置于250mL锥形瓶中,加入数粒碎瓷片。
②在水样中加入重铬酸钾标准溶液10.00mL,安装回流装置(如上图所示),从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应。
③冷却后加指示剂2d,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。
已知:Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O
请你回答下列问题:
(1)仪器c的名称: ;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当 时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。
(2)下列有关操作不正确的是 (用相应编号填写)
A.用硫酸亚铁铵溶液滴定时需上述仪器中的仪器b
B. 仪器c在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出
C.加入数粒碎瓷片的作用是可以防止液体暴沸
D.上述操作步骤③中在滴定时判断滴定终点的指示剂可以是甲基橙
E.加热回流结束后,要用蒸馏水对冷凝管管壁进行冲洗
(3)在加热回流过程中,可以用水浴作为恒温加热源吗?同时请说明理由。
(4)下列因素对测定水样中的COD能产生影响的有 (用相应编号填写)
①硫酸的用量 ②反应装置中的锥形瓶在反应前用蒸馏水洗涤
③重铬酸钾的用量 ④回流时间的长短
(5)实验室配制重铬酸钾标准溶液的主要步骤及装置如下所示: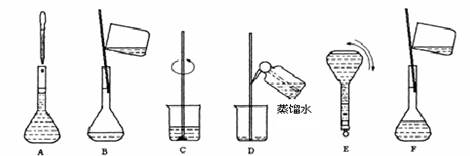
将上述实验步骤A到F按实验过程先后次序排列
(6)已知:重铬酸钾标准溶液的c(Cr2O72—)=0.0250mol·L—1,硫酸亚铁铵溶液的c(Fe2+)=0.0100 mol·L—1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为12.00mL,则按上述实验方法,测得的该水样的化学需氧量CODCr(O2)= mg/L
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O可用于摄影和蓝色印刷。实验室制备草酸合铁酸钾晶体的实验流程如下:
(1)若用铁和稀硫酸制备FeSO4·7H2O,常保持______过量,理由是___________________________________________________。
(2)上述流程中,“沉淀”一步所得FeC2O4·2H2O沉淀需用水洗涤。检验沉淀是否洗涤干净的方法是_________________________________________________________________。
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O42-含量的实验步骤如下:
步骤1:准确称取所制草酸合铁酸钾晶体a g(约1.5 g),配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入6 mol·L-1 HCl 10 mL,加热至70~80 ℃,趁热用SnCl2TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10 mL,在75~80 ℃下用0.010 00 mol·L-1 KMnO4标准溶液滴定至终点(Cl-不参与反应),将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积。
步骤3:……
步骤4:重复上述步骤2~步骤3两次。
①步骤2操作时,还需要使用如图所示仪器中的________(填序号)。
②步骤2中MnSO4溶液的作用是________,滴定终点的现象是______________________________________。
③在不增加试剂种类的前提下,步骤3的目的是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列装置不能完成的实验是( )
| | A | B | C | D |
| 装 置 |  |  |  |  |
| 实 验 | 结合秒表粗略测量锌与硫酸的反应速率 | 制备并收集少量NO气体 | 验证温度对化学平衡的影响 | 铁的析氢腐蚀实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com