
 ?2CO(g)中K=
?2CO(g)中K=| c2(CO) |
| c(CO2) |
 CO(g)+H2(g)中K1=
CO(g)+H2(g)中K1=| c(CO)c(H2) |
| c(H2O) |
 H2(g)+CO2(g)中K2=
H2(g)+CO2(g)中K2=| c(H2)c(CO2) |
| c(CO)c(H2O) |
| K1 |
| K2 |
| K1 |
| K2 |
| 10-12 |
| 10-9 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
 甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z | 甲 | 乙 |
| A | C | H2 | O2 | H2O | CO |
| B | Zn | Fe | Cl2 | Fe Cl2 | ZnCl2 |
| C | Mg | C | O2 | CO2 | MgO |
| D | H | Si | Cl2 | SiCl4 | HCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
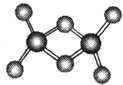 科学家合成了一种稳定的氢铝化合物,其熔点为150℃,可用作高能燃料或储氢材料.Al2H6的球棍模型如图所示.下列说法不正确的是( )
科学家合成了一种稳定的氢铝化合物,其熔点为150℃,可用作高能燃料或储氢材料.Al2H6的球棍模型如图所示.下列说法不正确的是( )| A、Al2H6可以燃烧,产物为氧化铝和水 |
| B、Al2H6是共价化合物 |
| C、Al2H6中所有原子在同一平面 |
| D、Al2H6是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂 |
| B、MgO、Al2O3的熔点很高,可制作耐高温材料 |
| C、Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品 |
| D、铜盐能使蛋白质变性,游泳场馆常用硫酸铜作池水消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、HClO的电子式为: |
B、CH4分子的球棍模型: |
| C、甲酸甲酯的实验式:CH2O |
| D、2-戊烯的结构简式:CH3CH2CH=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
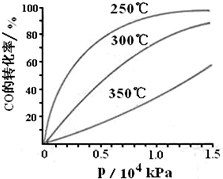 科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:
科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
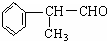 工业利用上述信息,按图所示的路线合成物质M(结构简式如右图所示),该物质是一种香料.
工业利用上述信息,按图所示的路线合成物质M(结构简式如右图所示),该物质是一种香料.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com