
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 反应物的性质是决定反应速率快慢的主要因素 | |
| C. | 相同体积、不同浓度的盐酸分别与大小、形状都相同的铁片反应的速率:1 mol•L-1时<0.1 mol•L-1时 | |
| D. | 在不同温度时,鲜牛奶变酸的速率:28℃时>5℃时 |
分析 A、利用化学反应速率来定量表示化学反应进行的快慢;
B、反应物本身的性质是决定化学反应速率快慢的主要因素;
C、浓度越大,反应速率越大;
D、温度高,反应速率快.
解答 解:A、化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故A正确;
B、反应物本身的性质是决定化学反应速率快慢的主要因素,故B正确;
C、浓度越大,反应速率越大,则不同浓度的盐酸分别与大小相同的铁片反应产生氢气的速率:0.1mol/L<1mol/L,故C错误;
D、温度高,反应速率快,则不同温度时,鲜牛奶变酸的速率:28℃>5℃,故D正确;
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、催化剂对反应速率的影响,注意反应物的本性为主要因素,题目难度不大.


科目:高中化学 来源: 题型:推断题
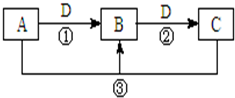 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a(A-N+3)}{A+3}$ | B. | $\frac{a(A-N+8)}{A+16}mol$ | ||
| C. | $\frac{a(2A-2N+40)}{2A+90}$ | D. | $\frac{2A-2N+24}{2A+54}mol$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
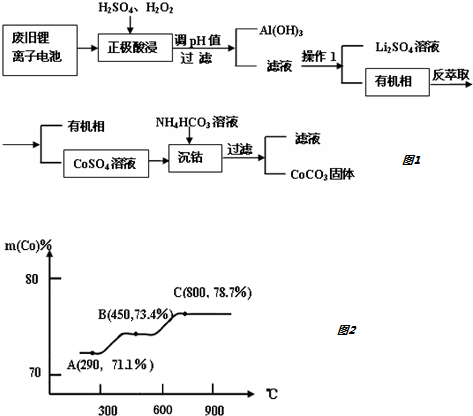
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
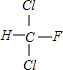 ;
;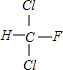 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$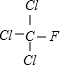 +HCl,生成氟氯昂可表示为F-11.
+HCl,生成氟氯昂可表示为F-11.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com