
| A. | 量取10mL该溶液倒入试管中,试管中,试管中Na+的物质的量为0.08mol | |
| B. | 该溶液的物质的量浓度为0.8mol•L-1 | |
| C. | 该溶液中含有46.8g NaCl | |
| D. | 配置50mL该溶液需用23.4g NaCl |
分析 A.溶液是均匀的,10mL溶液中Na+的物质的量为0.1L溶液中Na+的物质的量的$\frac{1}{10}$;
B.溶液中n(NaCl)=n(Na+),根据c=$\frac{n}{V}$计算判断;
C.根据m=nM计算溶液中NaCl的质量;
D.根据n=cV计算n(NaCl),再根据m=nM计算需要NaCl的质量.
解答 解:A.溶液是均匀的,10mL溶液中Na+的物质的量为0.8mol×$\frac{10mL}{100mL}$=0.08mol,故A正确;
B.溶液中n(NaCl)=n(Na+)=0.8mol,故NaCl的物质的量浓度=$\frac{0.8mol}{0.1L}$=8mol/L,故B错误;
C.溶液中n(NaCl)=n(Na+)=0.8mol,NaCl的质量=0.8mol×58.5g/mol=46.8g,故C正确;
D.50mL溶液中n(NaCl)=0.05L×8mol/L=0.4mol,故配制50 mL该溶液需用 NaCl的质量=0.4mol×58.5g/mol=23.4g,故D正确,
故选:B.
点评 本题考查学生对物质的量浓度理解,比较基础,故对公式的理解与灵活应用.


科目:高中化学 来源: 题型:多选题
| A. | 丙三醇 | B. | 1,2-丙二醇 | C. | 1,3-丙二醇 | D. | 乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
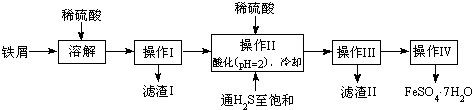
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
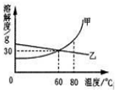 下表列出了固体物质A在不同温度时的溶解度:
下表列出了固体物质A在不同温度时的溶解度:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com