
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
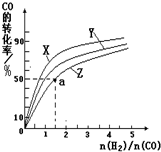
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
| c(CH3OH) |
| c(CO).c2(H2) |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 0.5 |
| 0.5×(0.5)2 |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、浓度均为0.02 mol?L-1的AgNO3和CH3COONa溶液混合一定产生CH3COOAg沉淀 |
| B、将0.1 mol/LAgNO3溶液逐滴加入到0.001mol/LKCl和0.001mol/LK2S溶液中,先产生AgCl沉淀 |
| C、要使Mg2+浓度为0.12 mol?L-1的溶液中产生Mg(OH)2的沉淀,溶液的pH≥9 |
| D、向0.1mol/L AgNO3溶液中滴加0.1mol/LNaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.则其离子方程式为:2Ag++S2-(aq)?Ag2S(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、m+n>p |
| B、A的转化率降低 |
| C、平衡向正反应方向移动 |
| D、C的质量分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60% | B、24% |
| C、30% | D、40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
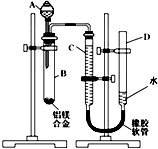 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
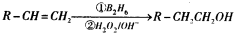
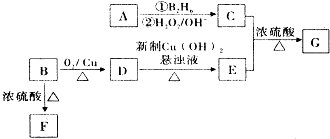
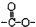 ”基团.
”基团.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com