
【题目】用酸式滴定管准确移取25.00 mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000 molL-1的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
NaOH溶液起始读数 | NaOH终点读数 | |
第一次 | 0.10 mL | 12.70 mL |
第二次 | 0.00 mL | 12.40mL |
(1)准确配制0.2000 molL-1的氢氧化钠溶液250 mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的玻璃仪器有____。
(2)根据以上数据可以计算出盐酸的物质的量浓度为___molL-1。
(3)用0.2000 molL-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视______,直到滴定终点。
(4)达到滴定终点的标志是____。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是____(填“偏高”或“偏低”或“不影响”)
【答案】250mL容量瓶、胶头滴管 0.1000 molL-1 锥形瓶内溶液颜色的变化 当最后一滴标准液滴下后溶液由无色变粉红色且30s内不变色(无色变红色不扣分) 偏高
【解析】
(1)依据标准溶液的配制步骤选择玻璃仪器;
(2)计算两次实验消耗NaOH溶液的平均体积,然后根据HCl~NaOH的关系式,结合c酸V酸= c碱V碱,求盐酸的物质的量浓度;
(3)观察滴定终点时,眼睛要注视锥形瓶内颜色的变化;
(4)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色;
(5)根据操作对c(测) = ![]() 的影响进行分析滴定误差。
的影响进行分析滴定误差。
(1)准确配制0.2000 molL-1的氢氧化钠溶液250 mL,需要250mL容量瓶盛装,定容时还需胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(2)两次消耗的NaOH溶液的体积分别为:12.60 mL,12.40 mL,两次消耗盐酸溶液的平均体积为12.50 mL,
HCl~NaOH
1 1
c(HCl)×25.00mL=0.2000mol/L×12.50mL
解得:c(HCl)=0.1000mol/L,
故答案为:0.1000 molL-1;
(3)滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到滴定终点,
故答案为:锥形瓶内溶液颜色的变化;
(4)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色,
故答案为:当最后一滴标准液滴下后溶液由无色变粉红色且30s内不变色(无色变红色不扣分);
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,导致读取的氢氧化钠体积V(标)偏高,
滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,依据c(测) = ![]() ,c(测)会偏高,对测定结果的影响会偏高,
,c(测)会偏高,对测定结果的影响会偏高,
答案为:偏高。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a 和 b 不连接时,铁片上会有金属铜析出
B. 无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
C. a 和 b 分别连接直流电源正、负极,铜片上发生的反应为:Cu-2e-=Cu2+
D. a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提溴:
浓缩海水![]() 粗产品溴
粗产品溴![]() 溴蒸气
溴蒸气![]() 物质X
物质X![]() 产品溴
产品溴
完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_______;足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因________。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:___,两者气态氢化物的稳定性是:_______>_______(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______(文字简述)。
(4)写出步骤③中反应的离子方程式(说明:此反应在水溶液中进行):_______;
(5)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为NaBr、NaBrO3,同时放出CO2,请写出该反应的化学方程式并标明电子转移方向与数目:_______。
(6)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物的转化有重大用途,回答关于CO和![]() 的问题。
的问题。
![]() 已知:
已知:![]()
![]()
![]()
则![]() 的
的![]() ______
______![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示![]() 。
。
![]() 对于化学平衡
对于化学平衡![]() ,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
随着温度升高,______、______

![]() 某温度下,将
某温度下,将![]()
![]() 和足量碳充入3L的恒容密闭容器中,发生如下反应:
和足量碳充入3L的恒容密闭容器中,发生如下反应:![]() ,达到平衡时测得
,达到平衡时测得![]() 为平衡常数
为平衡常数![]() ,求平衡时
,求平衡时![]() 的转化率___________?
的转化率___________?![]() 写出计算过程
写出计算过程![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag纯净的碳酸钠和ag碳酸钠与碳酸氢钠的混合物相比,下列描述正确的是( )
A.分别和盐酸反应时,混合物的耗酸量大
B.分别和足量盐酸反应时,混合物放出的CO2多
C.分别配制成等体积溶液,混合物碱性大
D.分别配制成等体积溶液,混合物的Na+的物质的量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,如果反应前后元素的化合价发生变化,就一定有_______转移,这类反应就属于_________反应。元素化合价升高,表明该元素的原子_____电子,含该元素的物质发生________反应;例如在Fe2O3+3CO![]() 2Fe+3CO2的化学反应中,_______是氧化剂,________是还原剂。
2Fe+3CO2的化学反应中,_______是氧化剂,________是还原剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)在容量瓶上,无需标记的是(______)
A.刻度线 B.温度 C.浓度 D.容积
(2)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是(______)
A.称量 B.溶解
B.溶解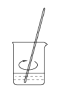
C.转移 D.定容
D.定容![]()
Ⅱ、实验室配制500mL 0.2mol·L-1的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀后装瓶。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)_____。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是_____、____。
(3)在配制过程中,其他操作都正确,下列操作会引起误差偏高的是____。(填序号)
①未洗涤烧杯、玻璃棒
②未等NaOH溶液冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图所示:

下列关于该高分子的说法不正确的是
A. 芳纶纤维可用作航天、航空、国防等高科技领域的重要基础材料
B. 完全水解产物的单个分子中,含有官能团一COOH或一NH2
C. 氢键对该高分子的性能有影响
D. 结构简式为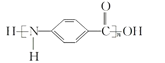
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com