


 阅读快车系列答案
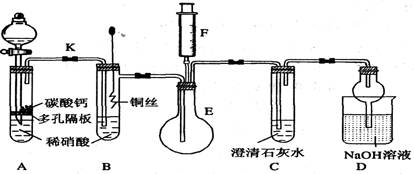
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
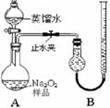
科目:高中化学 来源:不详 题型:单选题
| 实验 | 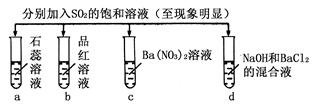 | ||||
| 记 录 | | a | b | c | d |
| A | 无色 | 不褪色 | 无色溶液 | 无色溶液 | |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
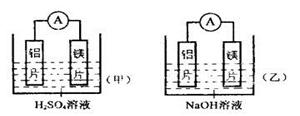
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动顺序表已过时,已设有实用价值 |
| D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析 |
 xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.苯和浓溴水用铁做催化剂制溴苯 |
| B.将苯与浓硝酸混合共热制硝基苯 |
| C.甲烷与氯气光照制得纯净的一氯甲烷 |
| D.乙烯通入溴的四氯化碳溶液得到1,2—二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
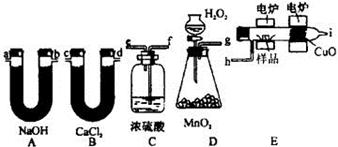
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
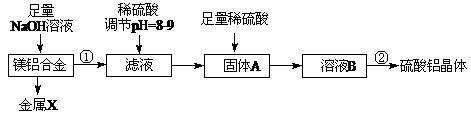
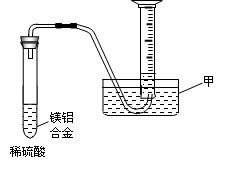
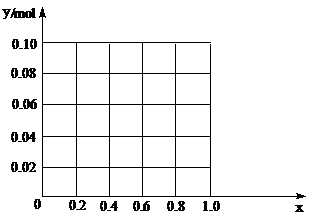
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com