
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。

讨论回答下列问题:
(1)①中加盐酸后的沉淀主要是___________(化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________(一种即可)。
(2)写出②、③中可能发生反应的离子方程式。
②_______________________、________________、_______________________、________________。
③_____________________、________________。
(3)步骤②中不用氨水沉淀Fe3+的原因:_____________。
【答案】SiO2 粉碎铝土矿、加热、增大盐酸的浓度(任填一种,其它合理答案亦可) H++OH-=H2O Al3++3OH-=Al(OH)3↓ Fe3++3OH-=Fe(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O OH-+CO2=HCO3- AlO2-+2H2O+CO2= Al(OH)3↓+HCO3- Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离
【解析】
(1) ①铝土矿中含有Al2O3及少量SiO2、Fe2O3等杂质,加入盐酸时,Al2O3、Fe2O3与盐酸反应产生AlCl3、FeCl3进入溶液,酸性氧化物SiO2与盐酸不反应,所以加盐酸后的沉淀成分主要是SiO2;为了加快铝土矿在盐酸中的溶解,可采取的措施有将铝土矿粉碎,增大物质的接触面积;加热来提高反应温度或增大盐酸的浓度等方法;
(2)②向含有HCl、AlCl3、FeCl3的溶液中加入足量NaOH溶液,首先发生反应:H++OH-=H2O;然后发生:Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,最后发生:Al(OH)3+OH-=AlO2-+2H2O;
③在滤液甲中含NaOH、NaAlO2,向其中通入过量CO2气体,可能发生反应为OH-+CO2=HCO3-;AlO2-+2H2O+CO2= Al(OH)3↓+HCO3-;
(3)步骤②中不用氨水沉淀Fe3+是因为加入碱时Al3+会形成Al(OH)3沉淀,Al(OH)3只能溶于强碱,不能溶于氨水,若用氨水就不能将Fe(OH)3和Al(OH)3分离开。


科目:高中化学 来源: 题型:
【题目】在2 A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. υ(A)=0.5mol/(L·s) B. υ(B)=0.3mol/(L· s) C. υ(C)=0.8mol/(L·s) D. υ(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
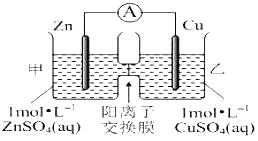
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
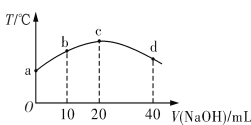
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===![]() +2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
+2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
A. 还原性Cr3+>Fe2+>SO2
B. 氧化性Cr2O72->SO2>Fe3+
C. 两个反应中Fe2(SO4)3均作还原剂
D. Cr2O72-能将Na2SO3氧化成Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是 ( )
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为: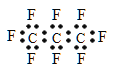
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu2O能与稀硝酸反应:Cu2O+HNO3→Cu(NO3)2+NO↑+H2O(未配平),若生成的NO在标况下的体积为0.448L,下列说法正确的是
A. 转移的电子总数为0.06NA
B. 作氧化剂的HNO3是0.14mol
C. 至少需要0.5mo/L的硝酸140mL与Cu2O反应
D. 被氧化的Cu2O是144g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为Fe2O3和CuO的混合物且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:

(1)写出步骤③可能发生反应的离子方程式:________________________(共有3个,任写一个即可)。
(2)若溶液E中只有一种金属离子,则一定是__________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com