
【题目】下列离子方程式写正确的是
A. 石灰石上滴加稀醋酸: CaCO3+2H+=Ca2++ H2O+CO2↑
B. 向沸水中滴加FeCl3溶液制Fe(OH)3胶体: Fe3++3H2O ![]() Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
C. 少量SO2通入Ca(ClO)2溶液中: SO2+ H2O + Ca2++ 2ClO-= CaSO3↓+2HClO
D. 澄清石灰水与少量小苏打溶液混合: Ca2++ OH-+ HCO3-=CaCO3↓+ H2O
【答案】D
【解析】A. 石灰石上滴加稀醋酸,反应的离子方程式为: CaCO3+2CH3COOH=Ca2++2CH3COO-+ H2O+CO2↑,选项A错误;B. 向沸水中滴加FeCl3溶液制Fe(OH)3胶体,反应的离子方程式为: Fe3++3H2O ![]() Fe(OH)3(胶体)+ 3H+,选项B错误;C. 少量SO2通入Ca(ClO)2溶液中,反应的离子方程式为: SO2+ H2O + Ca2++ 2ClO-= CaSO4↓+2H++2Cl-,选项C错误;D. 澄清石灰水与少量小苏打溶液混合,反应的离子方程式为: Ca2++ OH-+ HCO3-=CaCO3↓+ H2O,选项D正确。答案选D。
Fe(OH)3(胶体)+ 3H+,选项B错误;C. 少量SO2通入Ca(ClO)2溶液中,反应的离子方程式为: SO2+ H2O + Ca2++ 2ClO-= CaSO4↓+2H++2Cl-,选项C错误;D. 澄清石灰水与少量小苏打溶液混合,反应的离子方程式为: Ca2++ OH-+ HCO3-=CaCO3↓+ H2O,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.如图为一“链状连环”图案,图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.
请回答下列问题:
(1)请将分类依据代号填入相应的括号内.
两种物质都不是电解质
两种物质都是钠的化合物
两种物质都是氧化物
两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1molL﹣1的上图中一种化合物的水溶液,可制得一种红色胶体.
①反应的化学方程式为 .
②如何用较简单的方法判断胶体是否制备成功? .
③向该胶体中逐滴加入HI稀溶液,会出现一系列变化:
a.先出现红褐色沉淀,原因是 .
b.随后红褐色沉淀溶解,此反应的离子方程式是 . ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(H2O2)和水都是极弱的电解质,但H2O2 溶液显弱酸性。把H2O2 看成二元弱酸,则下列化学方程式不正确的是
A. H2O2 在水中电离的离子方程式:H2O2![]() H++HO2-
H++HO2-
B. 少量Na2O2与稀盐酸反应的离子方程式:O22-+2H+==H2O2
C. H2O2 稀溶液与Ba(OH)2稀溶被反应生成正盐的化学方程式:H2O2 +Ba(OH)2=BaO2+2H2O
D. H2O2 稀溶液与Ba(OH)2 稀溶液反应生成酸式盐的化学方程:2H2O2 +Ba(OH)2=Ba(HO2)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
序号 | ① | ② | ③ | ④ |
科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
上述科学家的研究按照时间先后排序合理的是(填数字序号).
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示. 
①门捷列夫将已有元素按照相对原子质量排序,同一(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是 , 第5列方框中“Te=128?”的问号表达的含义是 .
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A,B,D,E,X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示: ①上述七种元素中,处于第二周期的有(用元素符号表示,下同),X在周期表中的位置是 .
②E的原子结构示意图为 , 写出Z元素气态氢化物的电子式: .
③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为 .
④B和D的最高价氧化物的水化物的化学式分别为、 , 二者酸性前者(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质发生反应 ①Na和O2②AlCl3与氨水 ③水玻璃与CO2④Fe与Cl2⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
A.①②③④⑤B.①②③⑤C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期主族元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素,请回答:
(1)D在元素周期表中的位置是___________。
(2)C2B2的电子式是________
(3)B、C、E的离子半径由大到小的顺序为________(用离子符号回答); A、D、E元素最高价氧化物对应水化物的酸性由强到弱为_________(用化学式回答,下同),B的气态氢化物与H2S相比沸点高的是_____
(4)写出D的氧化物与氢氟酸反应的化学方程式____________
(5)水中锰含量超标容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50g EB2时,共转移了lmol电子,则反应的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上合成氨的反应原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 KJ/mol
2NH3(g) ΔH=-92.4 KJ/mol
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将______(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c(H2)将_______。
(2)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。若分别用VA(NH3)和VB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(NH3)_____VB(NH3)(填“>、“<”或“=")
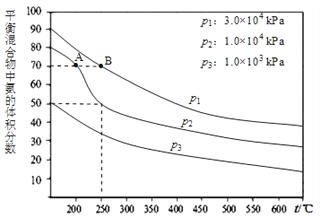
(3)①若恒温恒压下,在一容积可变的容器中,达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡____移动(“向正向“向逆向”“不”);
②若氮气与氢气以1:1混合反应时,达到平衡后,如果升高温度氮气的体积分数将____(“变大”“变小”不变”下同);如果增大压强氮气的体积分数将___。
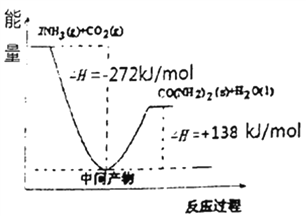
(4)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示:用CO2和氨合成尿素的热化学方程式为________。
(5)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究温度对酶活性的影响,某生物兴趣小组设计了如下实验方案。
①取6支试管,分别向其中加入4mL淀粉溶液;
②将试管分别放入0℃、20℃、40℃、60℃、80℃、100℃的恒温水浴锅中保温5min;
③向装有淀粉溶液的试管中滴加2滴淀粉酶溶液,立即放回水浴锅中并计时;
④每隔1分钟取2滴左右淀粉溶液,滴于多孔反应板上,滴加1滴碘液检测。记录取出的样液遇碘不呈蓝色所需的时间t。
分析回答下列问题:
(1)该实验的自变量是________________________________。
(2)不能选择过氧化氢酶和过氧化氢溶液进行探究,是因为_____________________________。
(3)该方案中淀粉酶溶液滴加2滴,不能过多,主要是为了避免___________________________。
(4)记录的实验结果如下表(“—”表示没有记录到实验结果):
温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
平均时间t | — | 7min | 3min | 2min | 7min | — |
请根据表中信息,用柱形图的形式表示温度对该酶活性的影响。___________________________。

实验结果表明该淀粉酶的最适温度范围是_______________。为进一步确定最适温度,需要________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com