


科目:高中化学 来源: 题型:
 Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O═BO2-+4H2↑(反应实质为水电离出来的H+被还原).研究表明,该反应生成H2的速率受外界条件影响.下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).
Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O═BO2-+4H2↑(反应实质为水电离出来的H+被还原).研究表明,该反应生成H2的速率受外界条件影响.下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).| 体系 pH |
不同温度下NaBH4的半衰期(min) | |||
| 0℃ | 25℃ | 50℃ | 75℃ | |
| 8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
| 10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
| 12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
| 14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
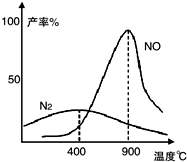
| n(NO) |
| n(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2 |
| B、N2O |
| C、NO |
| D、NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol |
| B、1mol |
| C、1.5mol |
| D、2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
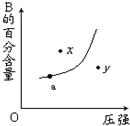 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A、m+n<p |
| B、n<p |
| C、a点时增加A的物质的量,B的百分含量减小 |
| D、x点的状态是v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| ||
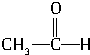 +H2
+H2| 催化剂 |
| 光照 |
| A、①③ | B、②③ | C、①② | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com