
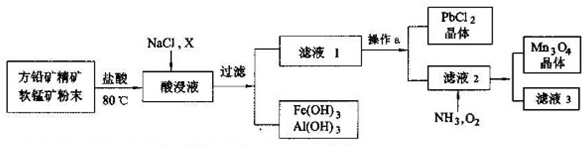
���� ��Ǧ����Ҫ�ɷ�PbS�������̿���Ҫ�ɷ�MnO2������Fe2O3��Al2O3�����ʣ��м���ϡ���Ტ������80�棬�����ķ�Ӧ��MnO2+PbS+4HCl=MnCl2+PbCl2+S+2H2O��Fe2O3+6HCl=2FeCl3+3H2O��Al2O3+6HCl=2AlCl3+3H2O���������Һ�м���NaCl��Һ��X��������Һ��pH��ʹ�����Ӻ�������ת��Ϊ������Ҫ��ȥ������������Ҫ������������Ҳ��������µ����ʣ�Ȼ����˵õ���������������������������Һ������Һ����Ũ������ȴ�ᾧ�����˵õ�PbCl2�������Һ������Һ��ͨ�백���������������ӱ���������Mn3O4������Һ���˵õ�Mn3O4����Һ��
��1�������ᴦ�����ֿ�ʯ��ĩ������PbCl2��S�����ݷ�Ӧ�����������д����ʽ��
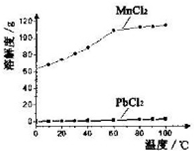
��2��PbCl2+2Cl-��aq��?PbCl42-��aq�������������Һ�м��뱥��ʳ��ˮ�ܴٽ�PbCl2�ܽ⣻
�����ڵ�����ҺpH������X�ܽ������ӡ�������ת��Ϊ�����Ҳ��������µ����ʣ�
��3������Һ�еõ������������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����������
��4������Һ2ͨ��NH3��O2�������ӱ���������Mn3O4��
��5����Һ3�к���NaCl��NH4Cl��
��6�������̿���������������Ϊԭ�ϣ�ͨ�����ȷ�Ӧ���Ʊ����÷�ӦΪ�û���Ӧ�������̺���������
��� �⣺��Ǧ����Ҫ�ɷ�PbS�������̿���Ҫ�ɷ�MnO2������Fe2O3��Al2O3�����ʣ��м���ϡ���Ტ������80�棬�����ķ�Ӧ��MnO2+PbS+4HCl=MnCl2+PbCl2+S+2H2O��Fe2O3+6HCl=2FeCl3+3H2O��Al2O3+6HCl=2AlCl3+3H2O���������Һ�м���NaCl��Һ��X��������Һ��pH��ʹ�����Ӻ�������ת��Ϊ������Ҫ��ȥ������������Ҫ������������Ҳ��������µ����ʣ�Ȼ����˵õ���������������������������Һ������Һ����Ũ������ȴ�ᾧ�����˵õ�PbCl2�������Һ������Һ��ͨ�백���������������ӱ���������Mn3O4������Һ���˵õ�Mn3O4����Һ��
��1�������ᴦ�����ֿ�ʯ��ĩ������PbCl2��S�����ݷ�Ӧ�����������д����ʽΪMnO2+PbS+4HCl=MnCl2+PbCl2+S+2H2O��
�ʴ�Ϊ��MnO2+PbS+4HCl=MnCl2+PbCl2+S+2H2O��
��2��PbCl2+2Cl-��aq��?PbCl42-��aq�������������Һ�м��뱥��ʳ��ˮ�ܴٽ�PbCl2�ܽ⣬������Ȼ�����Һ��Ŀ��������PbCl2�ܽ�ȣ�
�����ڵ�����ҺpH������X�ܽ������ӡ�������ת��Ϊ�����Ҳ��������µ����ʣ�������������AC��
�ʴ�Ϊ������PbCl2�ܽ�ȣ�AC��
��3������Һ�еõ������������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����������
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��4������Һ2ͨ��NH3��O2�������ӱ���������Mn3O4�����ӷ���ʽΪ6Mn2++12NH3+6H2O+2=2Mn3O4+12NH4+��
�ʴ�Ϊ��6Mn2++12NH3+6H2O+2=2Mn3O4+12NH4+��
��5����Һ3�к���NaCl��NH4Cl��NaCl���ظ����ã��Ȼ���������ϣ����������������ܻ������ã�
�ʴ�Ϊ��NaCl��NH4Cl��
��6�������̿���������������Ϊԭ�ϣ�ͨ�����ȷ�Ӧ���Ʊ����÷�ӦΪ�û���Ӧ�������̺�����������Ӧ����ʽΪ4Al+3Mn3O4$\frac{\underline{\;����\;}}{\;}$9Mn+4Al2O3���ʴ�Ϊ��4Al+3Mn3O4$\frac{\underline{\;����\;}}{\;}$9Mn+4Al2O3��
���� ���⿼�������Ʊ�ʵ�鷽����ƣ�Ϊ��Ƶ���㣬���ؿ���ѧ����ȡ��Ϣ������Ϣ��������������Ի���֪ʶ��������ã��漰����ʽ�����ӷ���ʽ����д��������ԭ��Ӧ�����ʷ�����ᴿ��֪ʶ�㣬��ȷ��Ӧԭ�������������ǽⱾ��ؼ�����Ŀ�Ѷ��еȣ�


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ���� | ����Һ��� | ������������������mL�� | |
| �ζ�ǰ | �ζ��� | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
| ������ | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| ��ɫ | �� | dz�� | �� | ש�� | �� |
| Ksp | 1.77��10-10 | 5.35��10-13 | 1.21��10-16 | 1.12��10-12 | 1.0��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�| ʵ�� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
| ���� | ����������Һ | �����Һ | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �۵�� | �е�� | �ܽ��� | ||
| ˮ | �� | �� | |||
| Ũ���� | 10.35 | 340 | ���� | ���� | ���� |
| ���� | -89.12 | 34.5 | �ܣ�������Һ���ܽ�Ƚ��ͣ� | ���� | ���� |
| �Ҵ� | -114.5 | 78.4 | ������ | ������ | ������ |
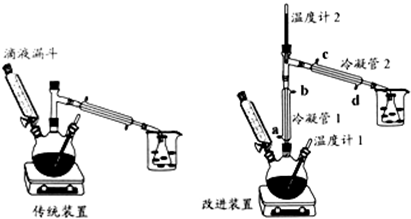
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
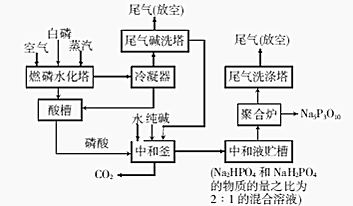
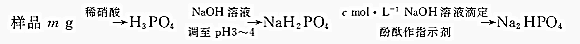
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com