
| 1.5g×90% |
| 27g/mol |
| 1.5g×90% |
| 27g/mol |
| 3 |
| 2 |
| 5mL |
| 100mL |
| 0.012mol |
| 0.6mol/L |


科目:高中化学 来源: 题型:
| A、用食醋可除去热水壶内壁的水垢 |
| B、合成纤维和光导纤维都是新型无机非金属材料 |
| C、酒精能使蛋白质变性,可用于杀菌消毒 |
| D、白酒用于增稠增香的塑化剂邻苯二甲酸二丁酯不溶于水,有毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
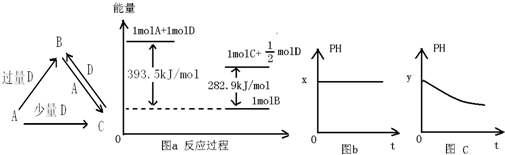
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| KMnO4/H+ |
| 浓H2SO4 |
| △ |
 nCH=CH+nCH=CH
nCH=CH+nCH=CH| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、存在不饱和键 |
| B、不易发生取代反应,易发生加成反应 |
| C、分子中的所有原子都处在同一条直线上 |
| D、能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com