
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中, 加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤② | 另取少量待测液于试管中,加入足量氯水,再加入四氯化碳,震荡,静置后观察颜色 | 下层出现红棕色,则证明 待测液中含有:Br- |
分析 (1)碱性条件下,Br2与Na2SO3溶液反应生成硫酸钠和NaBr;鉴定其中SO32-、SO42-和Br-离子;在氧化还原反应中化合价降低的物质为氧化剂,根据得失电子解答;
(2)加盐酸先排除亚硫酸离子,再利用硫酸钡白色沉淀的生成鉴定SO42-;利用萃取后,溴溶解在四氯化碳中,下层为橙红色,鉴定Br-.
解答 解:(1)碱性条件下,Br2与Na2SO3溶液反应生成硫酸钠和NaBr,该离子反应为SO32-+Br2+2OH-=H2O+SO42-+2Br-,
故答案为:SO32-+Br2+2OH-=H2O+SO42-+2Br-;
(2)①另取少量待测液于试管中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-,
故答案为:加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液;
②另取少量待测液于试管中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,
故答案为:另取少量待测液于试管中,加入足量氯水,再加入四氯化碳,震荡,静置后观察颜色;Br-.
点评 本题考查物质的组成及成分的测定,侧重二氧化硫和亚硫酸盐的性质的考查,把握发生的氧化还原反应、实验方案的设计为解答的关键,注意离子检验的应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
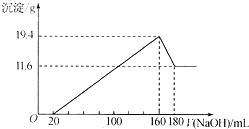 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
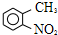 路线如下:
路线如下: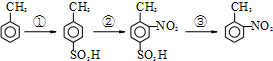 (反应条件略).推测该路线中磺酸基的作用防止甲基对位被硝基取代.
(反应条件略).推测该路线中磺酸基的作用防止甲基对位被硝基取代.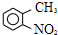 互为同分异构体,并同时满足下列条件的有机物有
互为同分异构体,并同时满足下列条件的有机物有 (写结构简式).
(写结构简式).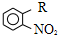 为原料,制取
为原料,制取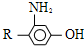 ,-R 基为d(填编号,下同)最合适;反应的合理顺序是f→e.
,-R 基为d(填编号,下同)最合适;反应的合理顺序是f→e. 合成
合成 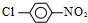 的化学方程式
的化学方程式 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,
+HCl, $→_{△}^{浓硝酸、浓硫酸}$
$→_{△}^{浓硝酸、浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
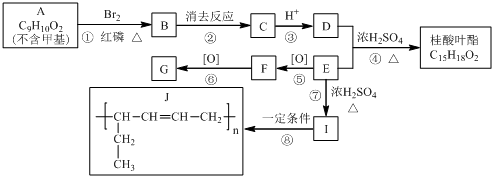
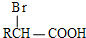 +H Br
+H Br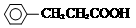 ,ICH3CH2CH=CHCH=CH2.
,ICH3CH2CH=CHCH=CH2.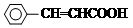 +CH3CH2CH=CHCH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH2CH=CHCH2CH2OH$→_{△}^{浓硫酸}$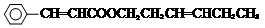 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可以使溴水褪色是因为它有漂白性 | |
| B. | 浓硫酸可用于干燥H2S和CO2 | |
| C. | 可以用加热法除去NaCl固体中的混有的NH4Cl | |
| D. | 过量的Cu与浓硝酸反应不可能有一氧化氮生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
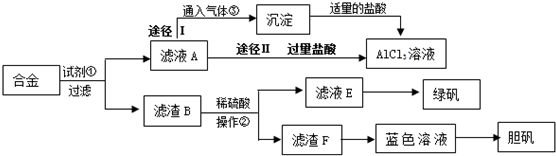
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com