
| A. |  向Ba(OH)2溶液中加稀H2SO4 | B. | 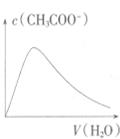 向冰醋酸中加蒸馏水 | ||
| C. |  向稀NaOH溶液中加稀盐酸 | D. | 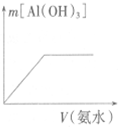 向AlCl3溶液中加氨水 |
分析 A.溶液的导电能力与离子浓度成正比;
B.向冰醋酸中加入蒸馏水,溶液浓度越小,其电离程度越大;
C.向稀NaOH溶液中加稀盐酸,溶液中氢氧根离子浓度减小、氢离子浓度增大,溶液的pH减小,但pH存在一个滴定突跃区间;
D.氯化铝和氨水混合生成氢氧化铝沉淀,氢氧化铝能溶于强碱但不能溶于弱碱.
解答 解:A.溶液的导电能力与离子浓度成正比,向向Ba(OH)2溶液中加稀H2SO4,二者反应生成硫酸钡沉淀和水,随着稀硫酸的加入,溶液中离子浓度减小,溶液的导电能力降低,当二者恰好反应时溶液导电能力最小,继续增加稀硫酸的量,溶液中离子浓度增大,溶液导电能力增大,故A正确;
B.向冰醋酸中加入蒸馏水,溶液浓度越小,其电离程度越大,刚开始时,随着蒸馏水的增加,溶液中醋酸根离子浓度增大,当增大到一定程度后,继续增加水的量,醋酸电离程度小于溶液体积增大程度,则溶液中醋酸根离子浓度降低,故B正确;
C.向稀NaOH溶液中加稀盐酸,溶液中氢氧根离子浓度减小、氢离子浓度增大,溶液的pH减小,正好反应前后,溶液的pH存在一个滴定突跃区间,在突跃区间内pH突然变化,而不是缓慢变化,图象和分析不一致,故C错误,D.氯化铝和氨水混合生成氢氧化铝沉淀,氢氧化铝能溶于强碱但不能溶于弱碱,所以只要加入氨水就产生沉淀,当氯化铝完全反应后继续增加氨水量,沉淀的量不变,故D正确;
故选C.
点评 本题考查图象分析,为高频考点,涉及酸碱中和、溶液导电能力判断、弱电解质的电离等知识点,明确物质的性质及反应原理是解本题关键,易错选项是C,注意酸碱中和滴定中pH变化,为易错点.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | Be原子的结构示意图: | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 质子数为53、中子数为78的碘原子可表示为:53131I | |
| D. | 乙烯的结构式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1所示装置制取干燥的氨气 | |
| B. | 图2装置可用于制取少量纯净的CO2气体 | |
| C. | 用图3所示装置将溶液定容到100 mL | |
| D. | 图4装置可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 过氧化钠只有氧化性,用过氧化钠为潜水艇舱提供氧气 | |
| D. | FeCl3具有氧化性,用FeCl3溶液刻蚀印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ( 2b+2c-a)kJ•mol-1 | B. | (a-2b-2c) kJ•mol-1 | ||
| C. | (b+c-a) kJ•mol-1 | D. | (a-2b-c) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 产生现象的原因 |
| A | 在氯化银浊液中滴加几滴稀KI溶液,白色沉淀变黄色 | 氯化银的溶度积小于碘化银的溶度积 |
| B | 在新制的氯水中滴加紫色石蕊溶液,溶液先变红色后褪色 | 氯水中有次氯酸,先电离出H+,使石蕊变红;后氧化有色物质 |
| C | 氨气通入酚酞溶液中,溶液变红色 | 氨气是一种碱,在水中电离出OH- |
| D | 借助导线,铜片和锌片在稀硫酸中构成原电池的两个电极,铜极表面产生气泡,锌极溶解 | 锌比铜活泼,锌失去电子,电子经外电路流向铜片,氢离子从铜片获得电子,最终产生氢气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 对“地沟油”进行分馏可以获得汽油发动机的燃料 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 | |
| D. | 工业上氯气和澄清石灰水为原料制造漂白粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com