
科目:高中化学 来源: 题型:
| 共价键 | H2分子 | N2分子 | NH3分子 |
| 键能(kJ?mol-1) | 436 | 945 | 391 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
在298K时,合成氨反应的热化学方程式

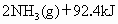 .在该温度下,取1mol
.在该温度下,取1mol 和3mol
和3mol 放在一密闭容器中,在催化剂存在时进行反应,放出的热量小于92.4kJ,其原因____________________________________.
放在一密闭容器中,在催化剂存在时进行反应,放出的热量小于92.4kJ,其原因____________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:038
在298K时,合成氨反应的热化学方程式

 .在该温度下,取1mol
.在该温度下,取1mol 和3mol
和3mol 放在一密闭容器中,在催化剂存在时进行反应,放出的热量小于92.4kJ,其原因____________________________________.
放在一密闭容器中,在催化剂存在时进行反应,放出的热量小于92.4kJ,其原因____________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
在298K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是 。
2NH3(g) △H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com