
| 选项 | 实验操作和现象 | 结论 |
| A | 向氢氧化镁的饱和溶液中滴加FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 等浓度的Na2CO3和Na2SO3溶液的pH,前者>后者 | 非金属性S>C |
| C | 金属镁片和铝片用灵敏电流计相连,伸入烧碱溶液中,发现镁片上有气泡 | 金属性Mg<A1 |
| D | 冰醋酸中加入水,氢离子浓度先增大,后减小 | 醋酸的电离程度先增大后减小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.生成红褐色沉淀,证明氢氧化镁沉淀转化成氢氧化铁,结合溶度积越小溶解度越小分析;
B.碳酸钠、亚硫酸钠对应的酸分别为碳酸氢根离子、亚硫酸氢根离子,无法比较碳酸与亚硫酸的酸性强弱;
C.铝与氢氧化钠溶液反应,Mg不反应,该现象不能证明二者金属性强弱;
D.醋酸的浓度越小,电离程度越大.
解答 解:A.向氢氧化镁的饱和溶液中滴加FeCl3溶液,出现红褐色沉淀,说明氢氧化铁更难溶,则Ksp[Mg(OH)2]>Ksp[Fe(OH)3],故A正确;
B.等浓度的Na2CO3和Na2SO3溶液的pH,前者>后者,只能说明碳酸氢根离子的酸性小于亚硫酸氢根离子,无法比较亚硫酸与碳酸的酸性强弱,则无法判断C、S的非金属性,故B错误;
C.由于Mg不与氢氧化钠反应,而铝能够反应,则该实验现象不能比较Mg、Al的金属性强弱,故C错误;
D.冰醋酸中加入水后,醋酸的浓度减小,醋酸的电离程度增大,所以稀释过程中醋酸的电离程度始终增大,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及难溶物溶解平衡、金属性、非金属性强弱比较、弱电解质的电离平衡及其影响等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 将CO中毒者转移到通风处抢救 | |
| B. | 皮肤上不慎沾有浓碱液,立即用大量水冲洗,然后涂上2% 的硼酸溶液 | |
| C. | 少量酒精失火时,立即用湿抹布盖灭 | |
| D. | 夜间进入厨房,闻到很浓的煤气味,立即开灯检查 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固态物质或液态物质的体积主要决定于构成这种物质的粒子的大小和粒子数目 | |
| B. | 在相同温度和压强下,任何气体粒子之间的距离可看成相等的 | |
| C. | 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 | |
| D. | 为与容量瓶的精度相匹配称量固体质量时不应用托盘天平 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O=4HF+O2反应中,水作还原剂,失电子 | |
| B. | 2Na+2H2O=2NaOH+H2↑反应中,水被氧化 | |
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O反应中,H2O是还原产物 | |
| D. | Na2O+H2O=2Na++2OH-反应中,水既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+6 Fe2++14H+═2Cr3++6 Fe3++7H2O | |
| B. | NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 用惰性电极电解MgCl2溶液2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
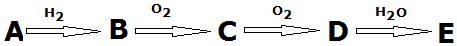
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-、SO42-、I-、Na+ | B. | Na+、Cu2+、S2-、NO3- | ||
| C. | K+、Al3+、HCO3-、SO42- | D. | Na+、K+、Cl-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、Cu2+、OH-、SO42- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Zn2+、NH4+、NO3+、Cl- | D. | K+、Na+、CO32-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com