
【题目】下列有关说法不正确的是( )
A. 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D. 金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
【答案】C
【解析】
![]() 水合铜离子中铜离子的配位数为4,配位体是H2O,H2O分子中的氧原子提供孤电子对与铜离子形成配位键,1个水合铜离子中有4个配位键,A正确;
水合铜离子中铜离子的配位数为4,配位体是H2O,H2O分子中的氧原子提供孤电子对与铜离子形成配位键,1个水合铜离子中有4个配位键,A正确;
B.根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为![]() ×8+
×8+![]() ×6=4,B正确;
×6=4,B正确;
C.电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会较多,C错误;
D.在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层有六个原子和上一层的三个及下一层的三个,所以每个原子周围都有12个原子与之相连,对于Ag原子也是如此,所以每个Ag原子的配位数均为12,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1mol·L-1的下列溶液:①盐酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤硫酸氢铵 ⑥氨水,请回答下列问题:
(1)已知t ℃时,Kw=1×10-13,则t ℃(填“>” “<”或“=”)__25℃。
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____。
(3)已知④溶液呈酸性,请用离子方程式表示___。
(4)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号)____。
(5)常温下,将①和③按体积比2:1混合后,溶液的pH约为____(已知lg3=0.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的分子式为![]() ,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为
,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为![]() 和
和![]() ,下列推断不正确的是
,下列推断不正确的是
A.![]() 分子的空间构型为“V”形
分子的空间构型为“V”形
B.![]() 键为极性共价键,
键为极性共价键,![]() 分子为非极性分子
分子为非极性分子
C.![]() 与
与![]() 相比,
相比,![]() 的熔点、沸点比
的熔点、沸点比![]() 的低
的低
D.![]() 分子的中心原子的成键轨道为
分子的中心原子的成键轨道为![]() 杂化轨道
杂化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l) ![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)已知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是____________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
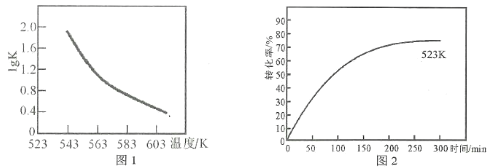
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列仪器可用于测定苯乙腈相对分子质量的是_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.红外光谱仪 D.质谱仪
(5)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
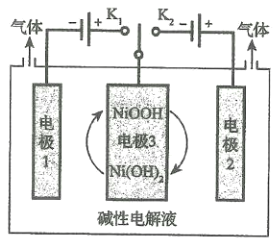
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是
A. 任何能使熵值增大的过程都能自发进行
B. △H<0,△S>0的化学反应一定能自发进行
C. 已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D. 稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中一定能大量共存的是
①pH=0的溶液:Na+、I-、NO3-、SO42-、
②pH=12的溶液中:![]() 、Na+、NO3-、S2-、
、Na+、NO3-、S2-、![]()
③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、![]() 、
、![]() 、
、![]() 、
、![]()
④加入Mg能放出H2的溶液中:Mg2+、![]() 、Cl-、K+、
、Cl-、K+、![]()
⑤使石蕊变红的溶液中:Fe2+、![]() 、Na+、
、Na+、![]()
⑥中性溶液中:Fe3+、Al3+、![]() 、Cl-、
、Cl-、
A.②④B.只有②C.①②⑤D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO45H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1molL-1NaClO溶液和0.1molL-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:

(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙烯的工业制法是_________。
a.石油裂化 b.煤干馏 c.石油裂解 d.石油分馏
(3)乙醛中的官能团名称是______,比乙醛少一个碳原子的同系物的结构简式是______。
(4)工业上用乙烯水化法制乙醇,乙烯在加热、加压和催化剂存在的条件下,跟水反应生成乙醇,该反应的化学方程式是_______________________。
(5)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,产生现象与对应的图形相符合的是( )
A.NaHSO3粉末加入HNO3溶液中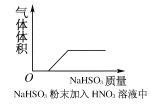
B.H2S气体通入氯水中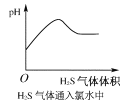
C.NaOH溶液滴入Ba(HCO3)2溶液中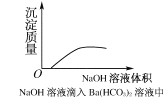
D.CO2气体通入澄清石灰水中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com