
| A. | 热化学方程式未注明温度和压强时,△H表示标准状况下的数据 | |
| B. | 热化学方程式中各物质前的化学计量数不表示分子个数,只代表物质的量 | |
| C. | 同一化学反应,化学计量数不同,△H不同;化学计量数相同而状态不同,△H也不相同 | |
| D. | 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
分析 A.未注明温度和压强时,是指在25℃,101KPa条件下测定的数据;
B.热化学方程式中的化学计量数只表示物质的量,不表示微粒数,系数可以用分数表示;
C.△H为反应热,表示化学反应过程中放出或吸收的热量;对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比;
D.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量,一个化学反应发生的条件与反应的热效应无关,与反应物的量有关.
解答 解:A.热化学方程式未注明温度和压强时,△H表示在25℃,101KPa条件下测定的数据,故A错误;
B.热化学方程式中的化学计量数只表示反应物或生成物的物质的量,不表示微粒数,系数可以用分数表示,故B正确;
C.化学反应的焓变(△H)只与反应体系的始态和终态有关,而与反应的途径无关,△H的单位是KJ/mol 与热化学方程式的化学计量数成正比,对于相同物质的反应,当化学计量数不同时,其△H 不同,与反应条件无关,所以同一化学反应反应条件不同,只要热化学方程式的化学计量数一定,△H值一定,故C正确;
D.化学反应放热、吸热关键看反应物和生成物所具有的总能量的相对大小或生成新化学键所释放的能量与断裂旧化学键所吸收的能量的相对大小,与化学反应发生的条件无关,化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比,故D正确;
故选A.
点评 本题主要考查了热化学方程式,掌握△H的含义以及与化学计量数间的关系是解答的关键,注意热化学方程式概念的运用,题目难度不大.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ +S↓ + H2O,下列各组实验中最先出现浑浊的是
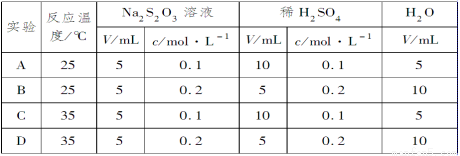
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
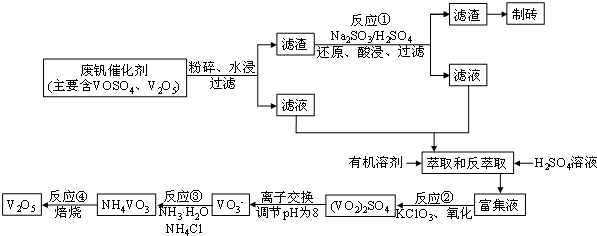
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨 | B. | D2与H2 | ||
| C. | CO与CO2 | D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
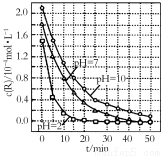
A.R的起始浓度越小,降解速率越大
B.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
C.溶液酸性越 强,R的降解速率越小
强,R的降解速率越小
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在转移液体前容量瓶中有少量蒸馏水 | |
| B. | 定容摇匀后,液面已低于容量瓶刻度线,此时再加水 | |
| C. | 转移时有少许液体沿容量瓶外壁流到实验桌上 | |
| D. | 定容时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com