
����Ŀ����ͨ��������,����ͼ��ʾװ�����Ҷ�ȩ(OHC-CHO)�Ʊ��Ҷ���(HOOC-COOH)���䷴ӦΪ:OHC-CHO+2Cl2+2H2O![]() HOOC-COOH+4HCl������˵����ȷ����
HOOC-COOH+4HCl������˵����ȷ����
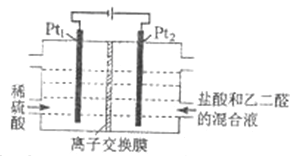
A. Pt1�ĵ缫��ӦΪ:2H2O+ 2e-=2OH-+H2��
B. �������ṩCl- ����ǿ�����Ե�����
C. ÿ����0.1mol�Ҷ�ȩ����Pt1���ų�2.24 L ����(��״��)
D. ÿ�õ�1mol�Ҷ��Ὣ��2 mol H+������Ǩ�Ƶ�����
���𰸡�B
��������A��Pt1�缫Ϊ������H+�õ���������������2H++2e-=H2����Aѡ�������ɵ�OH-�������Ṳ�棬A����B��������Cl-ʧȥ��������Cl2�����Ҷ�ȩ����Ϊ�Ҷ��ᣬͬʱ������ǿ��Һ�ĵ����ԣ�B��ȷ��C������0.1mol�Ҷ�ȩʱ��������0.2molCl2��ת�Ƶ�����ĿΪ0.4mol��������������H2�����ʵ���Ϊ0.2mol���ڱ�״���µ����Ϊ4.48L��C����D��ÿ�õ�1mol�Ҷ��ᣬ������2molCl2��ͬʱ����4molHCl�������ϱض�����4molCl-�������ϵ���4molH+��Ϊ�˱��ֵ����ԣ����ӽ���ĤӦʹ�������ӽ���Ĥ�����Ҳ�����4molH+��Ǩ�Ƶ����ң�D������ȷ��ΪB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŀ����Դ�ḻ������ijұ������(��Ҫ�ɷ�Ϊ�������������ͭ��Ǧ������������)��������ͭ��Ǧ�Ĺ�����������ͼ��ʾ:

�ش��������⣺
��1����¯ұ��ʱ����̿��������________(������������������ԭ����)������̿�����Ŀ����__________���ۼ�����Ҫ�ɷ��Ƿ�ʯ(CaF2)������������SiO2��Ӧ�������ָ��Σ�����֮һΪ CaSiF6���÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��![]()
��2�����������Һ�к���������Sn2+��Ϊ����������ʧ����������ͭ��Ǧ������Ԫ�Ͻ���մ�������Ӧ�����ӷ���ʽΪ____________________________��
��3����֪SnO2������ϡ���ᡣ�������������յ�Ŀ����__________________��
��4�����CuSO4��Һʱ�������ĵ缫��ӦʽΪ___________________________��
��5����֪H2CO3��һ���������볣���ֱ�ΪK1��K2��PbSO4��PbCO3���ܶȻ������ֱ�ΪKsp(PbSO4)��Ksp(PbCO3)������Ǧ���е�Ǧ��Ҫ��PbSO4���ڣ�����ʱ�����ķ�ӦΪ��
PbSO4(s)+HCO3��(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq)���÷�Ӧ��ƽ�ⳣ��K=___________(��������֪������ʾ)�����������ˡ�ϴ���ٽ�����һ�������������Ƿ�ϴ�Ӹɾ��ķ�����_____________________________��
PbCO3(s)+H+(aq)+SO42-(aq)���÷�Ӧ��ƽ�ⳣ��K=___________(��������֪������ʾ)�����������ˡ�ϴ���ٽ�����һ�������������Ƿ�ϴ�Ӹɾ��ķ�����_____________________________��
��6������ұ��������������������Ϊ5%��30t�����Ƶþ���lt�������Ļ�����Ϊ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������º��ݵ��ܱ������г���amolX��bmolY��������ӦX��g��+3Y��g��2Z��g���ﵽƽ��ʱ�����X��Y��ת���ʷֱ�Ϊ25%��37.5%����a��bΪ��������
A.1��3
B.3��1
C.3��2
D.1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ�Ͳ�Ʒ�г�����H2S�⣬�����и�����̬���л�����COS��CH3SH�ȡ�
�ش��������⣺
��1��CH3SH�������ĵ���ʽΪ__________��
��2��CO��H2S��Ӧ�ɲ����ʻ���( COS)����һ�����ܱ������з�����Ӧ��CO(g)+H2S(g)![]() COS(g)+H2(g)���ﵽƽ�⣬�������±���ʾ��
COS(g)+H2(g)���ﵽƽ�⣬�������±���ʾ��
ʵ�� | �¶�/�� | ��ʼʱ | ƽ��ʱ | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
�ٸ÷�Ӧ��________��Ӧ������ȡ����ȡ�����
��ʵ��1��ƽ��ʱ��CO��ת����Ϊ_______��
��ʵ��2�ﵽƽ��ʱ��a_______7.0�����������С�ڡ����ڡ�����
��ʵ��3��ƽ����ٳ���1.0 molH2��ƽ�ⳣ��ֵ____�������������С�����䡱����
��3��COS�Ǵ�����Ⱦ���������Һ�п���H2O2����COS����һ��ǿ�������ѳ���Ӧ�Ļ�ѧ����ʽΪ_______________��
��4����һ��������Ϊ�����K2CO3һ����˹����
��K2CO3��Һ����H2S�ķ�ӦΪK2CO3 +H2S =KHS +KHCO3���÷�Ӧ��ƽ�ⳣ���Ķ���ֵΪlgK=_____����֪��H2CO3 lgK1=-6.4��lgK,2=- 10.3��H2S lgKl=-7.0��lgK
����֪�����Ȼ�ѧ����ʽ��
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) ��H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) ��H2 = 632 kJ/mol
����˹��������ķ�ӦΪSO2��H2S���巴Ӧ����S(s)����÷�Ӧ���Ȼ�ѧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������N�Ǻϳ�ҩ����������ƣ����ƹؽ��ף�����Ҫ�м��壬��ϳ�·�����£�
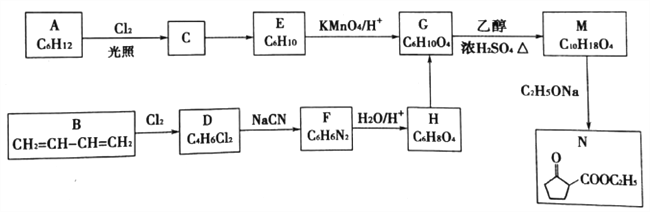
��֪����R��R1��R2��Ϊ������
��RCN ![]() RCOOH����R1CH=CHR2
RCOOH����R1CH=CHR2 ![]() R1COOH + R2 COOH
R1COOH + R2 COOH
�ش�����������
��1������֪��A�ĺ˴Ź���������ֻ��һ�����A��������________��
��N�����еĹ�����������________��
��2��D��F�ķ�Ӧ������________��C��E�ķ�Ӧ������___________��
��3����д��B��Cl2�����ʵ���1��1������Ӧʱ��Ҫ������Ľṹ��ʽ_________��
���ϳ�·��A��G��B��G���ţ�������������������______��_________���ŵ㡣
��4��д��G��M�Ļ�ѧ����ʽ__________________��
��5��д����������������H��һ��ͬ���칹��Ľṹ��ʽ___________��
��ֻ����һ�ֹ����ţ�������������ˮ�����ֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ����
A. �ǻ��ĵ���ʽ: ![]() B. ������Ϊ16����ԭ��:3115P
B. ������Ϊ16����ԭ��:3115P
C. ��ԭ�ӵĽṹʾ��ͼ: ![]() D. HClO�Ľṹʽ:H-C1-O
D. HClO�Ľṹʽ:H-C1-O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ����һ�ֹ�ҵ���ϣ���Ҫ�ɷ���MgO(MgOռ40%,����CaO��MnO��Fe2O3��FeO��Al2O3��SiO2������)���Դ�Ϊԭ����ȡ������þ��������ӡȾ����ֽ��ҽҩ�ȹ�ҵ������þ������ȡMgSO4��7H2O����������:
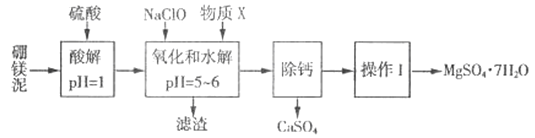
��������ش���������:
(1)ʵ��������1mol/L������800 mL������18.4 mol/L��Ũ���������ƣ�����ȡŨ����ʱ����ʹ�õ���Ͳ���Ϊ_______��(����ĸ)
A.10 mL B.25 mL C.50 mL D.100 mL
(2)�����NaClO �������Һ��Mn2+ ��Ӧ:Mn2+ + ClO-+H2O= MnO2 ��+ 2H+ + Cl-����Һ�л���һ������Ҳ�ᱻNaClO�������÷�Ӧ�����ӷ���ʽΪ___________���ò�����,����X��________(�ѧʽ)��
(3)���������г�MnO2��CaSO4 ���_______��(�ѧʽ)
(4)��֪MgSO4��CaSO4���ܽ�����±�:
�¶�/�� | 40 | 50 | 60 | 70 | |
�ܽ��/g | MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 | |
�����ơ��ǽ�MgSO4��CaSO4�����Һ�е�CaSO4��ȥ,�����ϱ�����,��Ҫ˵����������:____________��
(5)������I���ǽ���Һ����һϵ�в�������ո�����á���ո����ԭ����________��
(6)ʵ�����ṩ����þ�100g���õ���MgSO4��7H2O Ϊ147.6 g����MgSO4��7H2O�IJ���Ϊ________%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���漰������ԭ��Ӧ����
A.ʳ��ĸ���B.������ұ��C.���ʲ˵�����D.����ʯ���γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ӧ�����仯������ͼ��ʾ����

A. H2O2�ķֽⷴӦ B. Al������ķ�Ӧ
C. CaO��H2O�ķ�Ӧ D. Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com