
面对能源与环境等问题,
全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: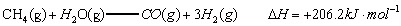
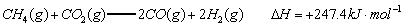
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。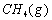 与
与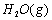 反应生成CO2(g)和
反应生成CO2(g)和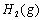 的热化学方程式为 。
的热化学方程式为 。
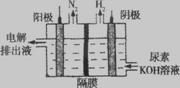
(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(3)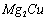 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,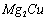 与
与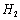 反
反
应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)。则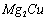 与
与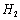 反应的化学
反应的化学
方程式为 。
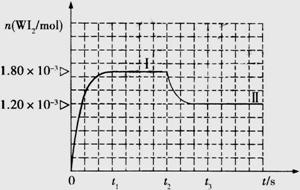
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: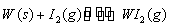 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的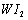 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
(4)该反应是 (填写“放热”或“吸热”)反应。在450℃时,该反应的平
衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或“变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
【知识点】盖斯定律、电化学原理、化学平衡的综合应用
【答案解析】(1)CH4(g)+2H2O(g)== CO2(g)+4H2(g)△H=+165.0kJ·mol-1(2分)
(2)CO(NH2)2+8OH--6e-===CO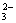 +N2↑+6H2O(2分)
+N2↑+6H2O(2分)
(3)2Mg2Cu+3H2 MgCu2+3MgH2(2分)
MgCu2+3MgH2(2分)
(4)放热(2分) 9(2分) (5)不变(2分) (6)不移动(2分)
解析::(1)①CH4(g)+H2O(g)═CO (g)+3H2(g)△H=+206.2kJ•mol-1,
②CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ•mol-1,
由盖斯定律可知,①×2-②可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),
其反应热△H=(+206.2kJ•mol-1)×2-(+247.4kJ•mol-1)=+165.0 kJ•mol-1,
即热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ•mol-1,
(2)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O;
(3)令金属氢化物为RHx,金属R的相对分子质量为a,则x/(a+x)=0.77即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为:2Mg2Cu+3H2 MgCu2+3MgH2;
MgCu2+3MgH2;
(4)升高温度,化学平衡向吸热方向移动;升高温度时,WI2的物质的量减少,所以该反应向逆反应方向移动,即逆反应是吸热反应,所以正反应是放热反应;反应开始时,碘的物质的量为n=0.508g÷254g/mol=0.002mol,反应达平衡时生成WI2,需要碘1.80×10-3mol参加反应,剩余碘0.0002mol,所以平衡时,c(WI2)=1.80×10−3mol÷0.05L=3.6×10-2mol/L,c(I2)=0.0002mol÷0.05L=0.004mol/L,K=0.036mol/L÷0.004mol/l=9
(5)该反应是等体反应,假设两个相同的容器达平衡时百分含量相等,温度不变压入同一容器中,增大压强,平衡不移动,故反应混合气体中I2的百分含量不变。
(6)综上,原平衡时,c(WI2)=3.6×10-2mol/L,c(I2)=0.004mol/L,温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则c(WI2)=0.144mol/L,c(I2)=0.016mol/L,Qc=0.144mol/L÷0.016mol/L=9,故平衡不移动。
【思路点拨】本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,掌握平衡常数、平衡移动的影响因素,注意对高考热点的训练。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.体积相等时密度相等 B.原子数相等时具 有的中子数相等
有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=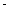 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
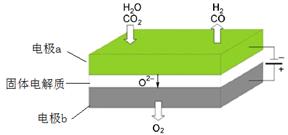
2CO(g)+O2(g)=2CO2(g) △H=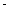 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
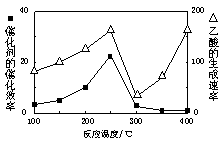
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
发展混合动力车是实施节能减排的重要措施之一。混合动力车的电动机目前一般使用的是镍氢电池。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为: H2+2NiOOH 2Ni(OH)2
2Ni(OH)2
下列有关混合动力车的判断正确的是( )
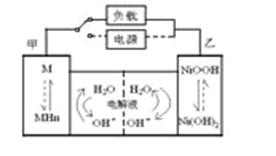
A.在上坡或加速时,每消耗22.4LH2,从电极甲流向电极乙的电子是2mol
B.在上坡或加速时,乙电极周围溶液的pH将减小
C.在刹车和下坡时,溶液中的K+向乙电极迁移
D.在刹车和下坡时,甲电极的电极反应式为2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
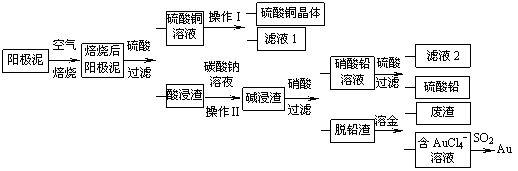

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图所示,下列判断错误的是( )
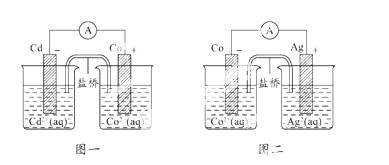
A.还原性:Co>Cd>Ag
B.还原性:Ag>Co>Cd
C .氧化性:Co2+>Cd2+>Ag+
.氧化性:Co2+>Cd2+>Ag+
D.氧化性:Ag+>Co2+>Cd2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
________ +________
+________ +________
+________ →________
→________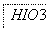 +________
+________
(2)整个过程中的还原剂是________.
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变 化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________________________________.
化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________________________________.
(4)加碘盐中含碘量为20 mg~50 mg/kg.制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
X为某金属矿的主要成分,X具有下列转化关系(部分反应物、生成物没有列出)。

已知:1 mol X经一系列变化只生成A、B、C,且物质的量之比为1∶2∶1,X不含氧元素。请回答:
(1)X的化学式为________;
(2)写出物质A名称________;物质G名称:________;
(3)写出下列反应方程式:
C+E—→B+F__________________________________;
生成红色沉淀G___________________________________
___________________________ ______________________;
______________________;
(4)工业生产纯净C的方法是________;其阴极电极反应式是:________;
(5)已知反应②的热化学方程式为:2B(g)+O2(g)2D(g) Δ<0
该反应平衡常数表达式为:________;
升高温度 K值的变化是:________。(填“变大”、“变小”或“不变”)
K值的变化是:________。(填“变大”、“变小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com