
����Ŀ��������ʵ������һ���ܵó���Ӧ���۵���
ѡ�� | A | B | C | D |
װ�û���� | ȡ��֧�Թܸ�����4 mL 0.01 mol/L�IJ�����Һ���ֱ�μ�2 mL 0.1 mol/L��0.2 mol/L�ĸ��������Һ |
|
| ��ֱ�ʢ��5 mL 0.1 mol/L�������������Һ���Թ��еμ�5 mL 0.1 mo/L��������Һ��һ��ʱ��ֱ������ˮ����ˮ�С� |
���� | ��ɫ���۲���ɫ��ʱ�� | ��������ƣ��ұ�������� | �Թ����ȳ��ֵ���ɫ���壬����ֻ�ɫ���� | �Թ���Һ����������ˮ�����ȳ��ֻ��� |
���� | ������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� | �����ԣ�Cl2>Br2>I2 | �ܽ�ȣ�AgCl>AgBr>AgI | ����˵���¶�Խ�ߣ�����Խ�� |
A.AB.BC.CD.D
���𰸡�D
��������
A. Ӧ�ð�ͬ�������ͬŨ�ȵIJ�����Һ���뵽��ͬ�������ͬŨ�ȵ�KMnO4��Һ�У�������Һ��ɫʱ��ij����ж�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ʵ�����˳��ߵ������ܹ��õ���ȷ���ۣ�A����
B. Cl2��NaBr�����û���Ӧ����Br2��ʹ��������ƣ�Br2�ӷ��������ұߵ�������KI�����û���Ӧ����I2��I2��������Һ����ɫ���ұ������Ϊ��ɫҲ�п����ǹ�����δ��Ӧ��Cl2��KI�����û���Ӧ������I2���£���˲���֤�������ԣ�Cl2>Br2>I2��B����
C. ��2 mL����AgCl����Һ���Թ��еμ�2��NaBr��Һ����������ɫ��������֤�����ʵ��ܽ��AgCl>AgBr������������AgCl����Һ�������������û�����еμ�2��NaI��Һʱ��������ɫ������ֻ�ܵõ����ۣ��ܽ�ȣ�AgCl>AgI��������֤�����ʵ��ܽ��AgBr>AgI��C����
D. ������Һ���ǰ���ʵ�Ũ����ȣ����Ҳ��ͬ����Ϻ���Ѿ������˻�ѧ��Ӧ��Ȼ���ٷֱ���벻ͬ�¶ȵ�ˮ���Ѿ����κ����壬����˵���¶�Խ�ߣ�����Խ�졣Ӧ�ð�2֧ʢ��5 mL 0.1 mol/L��Na2S2O3��Һ���Թܺ�2֧ʢ��5 mL 0.1 mo/L��������Һ�ֳ����飬һ�������ˮ�У�һ�������ˮ�У�һ��ʱ�����ÿһ����������ʵ�ˮ��Һ�����ݷ�Ӧ���ֻ��ǵĿ��������Ƚ��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬D��ȷ��
�ʺ���ѡ����D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������о����ض���ȼ�ϵ�أ���ҺҲ�ܷ��硣�����ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ�����ܷ��磬����ȼ�ϵ�ؽṹ��ͼ��ʾ�������й�������ȷ����
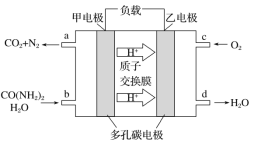
A. ��ع���ʱH������
B. �õ���õĵ������Һ��KOH��Һ
C. �缫��Ӧʽ��CO(NH2)2��H2O+6e��===CO2��N2��6H��
D. ��ع���ʱ��������ÿ����1 mol CO(NH2)2�����ı��������33.6 L O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ�����������������
A.7.8gNa2O2�����ˮ��Ӧת�Ƶ�����Ϊ0.1NA
B.1 mol OD-���Ӻ��е����ӡ���������Ϊ9NA
C.46g NO2��N2O4��������к���ԭ������Ϊ3NA
D.��֪N2��g��+3H2��g��![]() 2NH3��g����H=��92.4kJ��mol��1������3NA������ת��ʱ����H��Ϊ��46.2kJ��mol��1
2NH3��g����H=��92.4kJ��mol��1������3NA������ת��ʱ����H��Ϊ��46.2kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͪ�����![]() ��
��![]() ����һ�ֺϳ�·�����£�
����һ�ֺϳ�·�����£�

��֪��![]()
�ش��������⣺
��1��![]() ������Ϊ_______��
������Ϊ_______��![]() �Ĺ���������Ϊ_____________��
�Ĺ���������Ϊ_____________��
��2��![]() �ķ���ʽΪ_____________________��
�ķ���ʽΪ_____________________��
��3��![]() �ķ�Ӧ����Ϊ____________________��
�ķ�Ӧ����Ϊ____________________��
��4��![]() �ķ�Ӧ����ʽΪ_________________��
�ķ�Ӧ����ʽΪ_________________��
��5��M��E��ͬ���칹�壬�����������������к˴Ź���������4�����շ壬�����֮��Ϊ![]() �ĽṹΪ__________________��
�ĽṹΪ__________________��
���ܷ���ˮ�ⷴӦ ����![]() ��ɫ
��ɫ
��6�����������ϳ�·�ߣ�д���ñ���ϩ�뱽��ȩΪԭ���Ʊ����ͪ��![]() ���ĺϳ�·�ߣ������Լ���ѡ����________________
���ĺϳ�·�ߣ������Լ���ѡ����________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ��������������Cl2��Ȳ��������������DZ��Σ�����л��ȴ����֪: ClO2Ũ�ȹ��������ֽ⣬�����ᱬը�����������Ʊ�ClO2�ķ���:
��1������һ��������
�����������ƺ�ϡ����Ϊԭ���Ʊ�����Ӧԭ��Ϊ5NaClO2+4HCl=5NaCl+4ClO2��+2H2O��
�ٸ÷�Ӧ���������ͻ�ԭ�������ʵ���֮����_______________________��
���о�����������Ӧ��ʼʱ����Ũ�Ƚϴ��������������Cl2�������ӷ���ʽ���Ͳ���Cl2��ԭ��__________________________________________________��
��2�������������ỹԭ��
��������Һ���ò��ᣨH2C2O4����ԭ�����Ƶķ������Ʊ�ClO2
��д���Ʊ�ClO2�����ӷ���ʽ��__________________________________________��
�����ⷨ��ȣ��ò��ỹԭ���Ʊ�ClO2���ص���____________________����������������漰������̵İ�ȫ�ԡ�
��3����֪: ClO2��I-��ԭΪClO2-��Cl-��ת��������ҺpH �Ĺ�ϵ��ͼ��ʾ����pH<2.0 ʱ��ClO2-Ҳ�ܱ�I- ��ȫ��ԭΪCl-����Ӧ���ɵ�I2��Na2S2O3 ��Ӧ�ķ���ʽ: 2Na2S2O3+ I2= Na2S4O6 + 2NaI����ClO2����������ˮ�к���ClO2��ClO2-���ⶨ����ˮ��ClO2��ClO2-�ĺ���������������:
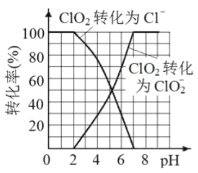
��������ֹ��ȷ����ˮ����ClO2�ĺ���Ϊa mol/L��
���õζ�������ClO2-�ĺ������������Ӧ��ʵ�鲽��:
����1: ȷ��ȡV mL ����ˮ��������ƿ�С�
����2: ����ˮ����pHС��2��
����3: ����������KI ���壬��ַ�Ӧ��
����4: ��������������Һ����c mol/L Na2S2O3 ��Һ�ζ����յ㣬����Na2S2O3 ��ҺV1 mL��
���������������ݣ���ø�����ˮ��ClO2-��Ũ��Ϊ___________mol/L( �ú���ĸ�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǽ�����һ�ּ���Ӧ��ǰ����ҽ�ø߷��Ӳ��ϡ�ij�ǽ������Ʊ�ԭ��Ϊ������Ԫ������ϳ�ԭ�����£�
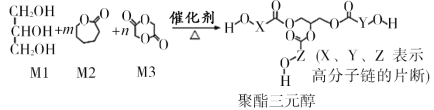
��֪��R1COOR2��R318OH![]() R1CO18OR3��R2OH
R1CO18OR3��R2OH
����˵����ȷ����
A.����Ml���������ƻ�ױƷ���ҷ����к���3������̼ԭ��
B.�ı�Ml�����ֵ����еı������ɵ��ؾ�����Ԫ������Է�������
C.�úϳɷ�ӦΪ���۷�Ӧ
D.X��Y��Z�а����ĽṹƬ�ο�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016���й���ѧ�ҳɹ��ϳ�NiO/TiO2���ˮ����������Ч�ĸ��ѿ�̫���ܵ�أ�Ϊ�����ԴΣ�����������������ش��ס���ش��������⣺
(1)TiO2�뽹̿��Cl2�ڸ����·�Ӧ�Ļ�ѧ����ʽΪ��TiO2+2C+2Cl2 ![]() TiCl4+2CO��
TiCl4+2CO��
�ٻ�̬��ԭ�ӵļ۵����Ų�ʽΪ_________________��
�ڸ÷�Ӧ���漰���ķǽ���Ԫ�صĵ縺�Դ�С˳��Ϊ_______________________��
(2)��֪NiO/TiO2������������ɻ������ҵĹ�����ͼ��ʾ��

������ķе�С�ڻ������ҵķе㣬��Ҫԭ����___________________���ڻ��������У���ԭ�ӵ��ӻ���ʽ��______________��
(3)CH3NH3+��Ti4+��Pb2+��Cl-����������������ѿ�̫���ܵ�ص���Ҫ���ӡ�CH3NH3+������H��N��H���ļ��DZ�NH3������H��N��H���ļ��� ______ �����С������ԭ����_____________ ��
(4)Sb(��)��Ga(��)��±�����кܶ���;��һ�������½�SbCl3��GaCl3�����ʵ���֮��Ϊl��l��Ӧ�õ�һ�ֹ�̬���ӻ��������������������ֽṹ������Ϊ���й��ڽṹ��˵���к������� ____ ��
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. û��������ϣ����ж�
(5)�����Ѿ���(��ͼ1��ʾ)�������ɸ����������϶��ͼ1��a��b��c��d�ĸ���ԭ���γɵ������������ڲ���϶�п����������ԭ�ӡ�
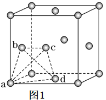
����ش𣬽����Ѿ����Ľṹ����____________��
a. ������ b. �������� c. �������� d. ���ʯ��
�������������е����������϶�ж������ԭ�ӣ���ô�γɵ��⻯�ѵĻ�ѧʽΪ______________��
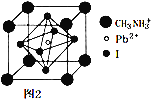
(6)ij���ѿ�̫���ܵ�ز��ϵľ�����ͼ2��ʾ���侧������Ϊd pm���ܶ�Ϊ�� g��cm-3����þ����Ħ������________ g��mol-1�����ú�d�����ȷ��ŵ�ʽ�ӱ�ʾ����NA��ʾ�����ӵ�������ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a L NH3ͨ��ij��ѹ���ܱ������У���һ������������ֽ⣬�ﵽƽ��������������b L(�����������ͬ�����²ⶨ)������˵������ȷ����( )
A.ƽ������ķֽ���Ϊ![]()
B.ƽ��������H2���������Ϊ![]()
C.��Ӧǰ��������ܶȱ�Ϊ![]()
D.ƽ��������ƽ��Ħ������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����㻯����A��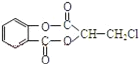 ����һ�������¿��Է�����ͼ��ʾ��ת�������������ˮ����ȥ����
����һ�������¿��Է�����ͼ��ʾ��ת�������������ˮ����ȥ����
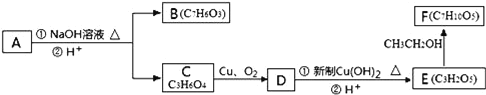
��ش��������⣺
��1����д��A�а����Ĺ����ŵ����ƣ�__��
��2���л���C���������ᾭ�������л���Ӧ�Ƶã�������ѵĴ�����__��
A����ȥ���ӳɡ�ˮ�⡢�ữ B���������ӳɡ�ˮ�⡢�ữ
C��ȡ����ˮ�⡢�������ữ D����ȥ���ӳɡ�ˮ�⡢����
��3��д����E�Ƶ�F�Ļ�ѧ����ʽ��__��
��4��1molA������������Һ�м��ȣ���ַ�Ӧ������������__mol��д���÷�Ӧ�Ļ�ѧ����ʽ��__��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com