
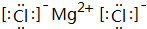 .
.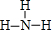 .
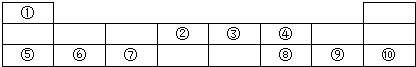
.分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)元素⑥和⑨形成的化合物为MgCl2,由镁离子与氯离子构成;
(2)元素③的最低价氢化物为NH3;
(3)元素⑤、⑥、⑦的最高价氧化物对应的水化物分别为NaOH、Mg(OH)2、Al(OH)3,其中氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(4)非金属性越强,最高价含氧酸的酸性越强;
(5)非金属性越强,对应氢化物越稳定.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)元素⑥和⑨形成的化合物为MgCl2,由镁离子与氯离子构成,电子式为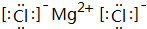 ,
,
故答案为: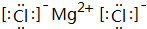 ;
;
(2)元素③的最低价氢化物为NH3,其结构式为: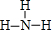 ,
,
故答案为: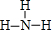 ;
;
(3)元素⑤、⑥、⑦的最高价氧化物对应的水化物分别为NaOH、Mg(OH)2、Al(OH)3,其中氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性HClO4>H2SO4,
故答案为:HClO4;
(5)非金属性O>S,非金属性越强,对应氢化物越稳定,故H2O更稳定,不易分解,
故答案为:H2O.
点评 本题考查元素周期表与元素周期律综合应用,注意对元素周期律与元素化合物性质的掌握,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 影响空气质量的一组气体污染物主要是CO2、SO2、NO2 | |
| B. | SO2、氮氧化物的排放会造成酸雨,酸雨的PH≥5.6 | |
| C. | 氮氧化物不仅能形成酸雨,而且还成形成光化学烟雾,破坏臭氧层 | |
| D. | 建高烟囱可以有效降低地面SO2的浓度,从而降低对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
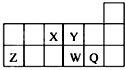
| A. | 元素Y的氢化物比元素X的氢化物稳定 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的碳与CO2的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2:3混合的Fe3O4与FeO | B. | 3:5:4混合的Fe3O4、FeO与Fe | ||
| C. | 4:5混合的Fe2O3和FeO | D. | 1:1:4混合的Fe2O3、Fe3O4与FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
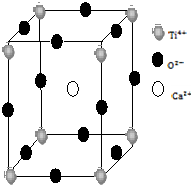 金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.
金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | N2的电子式: | ||
| C. | 硫离子结构示意图: | D. | CH4分子的比例模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com