
| A. | 硒化氢不稳定 | |
| B. | 酸性强弱顺序:HClO4>H3AsO4>H2SeO4 | |
| C. | 硒与铁反应可生成FeSe | |
| D. | 最高氧化物的化学式是SeO3 |
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
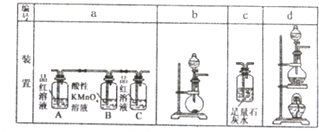 盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题:
盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH- Mg2+ NH4+Cl- | B. | Cl- K+ Na+ Ba2+ | ||
| C. | Ba2+Cl-Cu2+ NO3- | D. | H+ Na+ CO32-Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
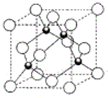 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
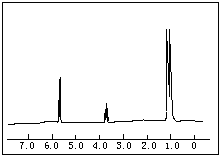 (1)已知1-丙醇和2-丙醇的结构简式如图:
(1)已知1-丙醇和2-丙醇的结构简式如图: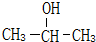
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
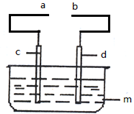 某小组为研究电化学原理,设计如图所示装置:
某小组为研究电化学原理,设计如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | N2→NO→NO2→HNO3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | S→SO3→H2SO4→MgSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com