
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
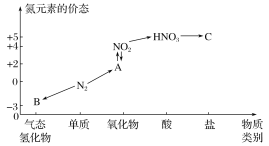
(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C常用于检验Cl-的在,则C的化学式为___。
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
【答案】做保护气(或做冷冻剂、制氨气等) AgNO3 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 3NO2+H2O===2HNO3+NO 4HNO3(浓)+C
CaCl2+2NH3↑+2H2O 3NO2+H2O===2HNO3+NO 4HNO3(浓)+C![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】
(1)由于氮气的化学性质不活泼,所以可做保护气,也可做冷冻剂、制氨气等;
(2)检验Cl-的方法是先向待测液中加入硝酸酸化,再滴加AgNO3溶液,若产生白色沉淀,则证明待测液中含有Cl-,因此C为AgNO3;
(3)B是NH3,在实验室中用铵盐与碱共热来制取NH3,化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)A是NO,NO2与水反应生成NO的化学方程式为3NO2+H2O=2HNO3+NO;
(5)浓硝酸有强氧化性,与木炭在加热条件下发生反应生成CO2、NO2和H2O,反应的化学方程式为4HNO3(浓)+C![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
B. 苯甲酸的结构简式为![]()
C. 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车
D. C5H10的同分异构体中属于烯烃的有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
⑴过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
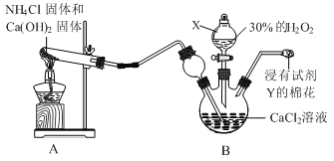
①装置A中发生反应的化学方程式为______。
②仪器X的名称为______;Y是______。
③为提高CaO2·8H2O产率,装置B的温度需控制在0℃,可采取的方法是______。
⑵测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.5000 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液体枳为20.00 mL。求产品中CaO2·8H2O的质量分数。(写出计算过程)_____________
已知:CaO2·8H2O+2KI+2H2SO4=CaSO4+2K2SO4+I2+10H2O
I2+2S2O32-=2I-+ S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将18.0 g由Cu、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了5.4 g。另取等质量的合金溶于过量稀HNO3中,生成了8.96 L NO(标准状况下),向反应后的溶液中加入过量的NaOH溶液,则沉淀的质量为
A.22.8 gB.25.4 gC.33.2gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为:
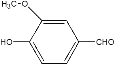 +
+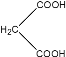
![]()
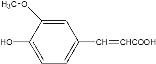 +H2O+CO2
+H2O+CO2
下列说法正确的是( )
A.可用酸性![]() 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与![]() 、
、![]() 溶液反应
溶液反应
C.通常条件下,香兰素.阿魏酸都能发生取代、加成、氧化反应
D.![]() 香兰素最多可以与
香兰素最多可以与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性强于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是
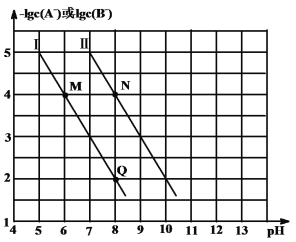
A.曲线Ⅰ表示溶液的pH与-lgc(B-)的变化关系
B.Ka(HA)∶Ka(HB)=1000∶1
C.溶液中水的电离程度:M<N
D.N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新药H的一种合成路线如图:
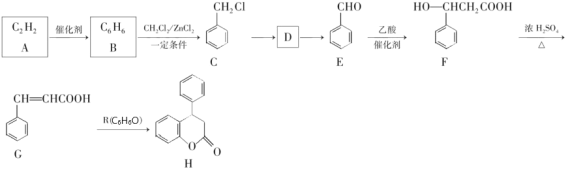
已知:A能使溴水褪色,R遇氯化铁溶液发生显色反应。
(1)R的名称是____________________;G中所含官能团名称是______________。
(2)C→D的反应条件和试剂是____________;E→F的反应类型是___________。
(3)能检验H含酯基的仪器名称是_________。A→B的原子利用率为___________。
(4)写出D→E的化学方程式:____________。
(5)在G的同分异构体中,同时满足下列条件的同分异构体有_______种。
①属于苯的衍生物;
②能发生水解反应和银镜反应;
③能与溴的四氯化碳溶液发生加成反应。
(6)参照上述合成路线,设计一条由乙烯、乙酸为原料制备![]() 的合成路线__________
的合成路线__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是有机物R 的结构简式,它可用于生产 S﹣诱抗素,下列关于R 的说法正确的是
( )
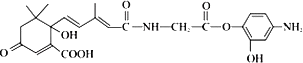
A.R 结构中含手性碳原子数多于 1 个
B.R 可以在酸性条件下充分水解生成两种有机产物
C.R 可以发生氧化、取代、加聚、缩聚反应,并能与盐酸反应生成有机盐
D.1 mol R 分别与足量NaOH 溶液、足量溴水反应,最多消耗 4 mol NaOH 和 5 mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com